Le site des ophtalmologistes de France
Encyclopédie de la vue
Vous êtes ici
DMLA et les nouveaux traitements anti-angiogénèse
Nouveaux traitements anti-angiogénèse de la DMLA

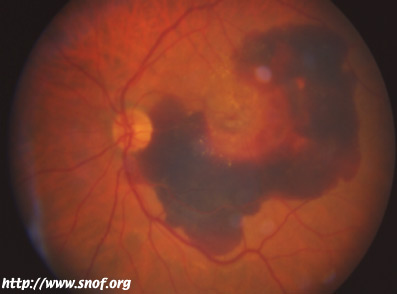
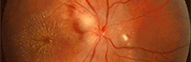
DMLA hémorragique due à une angiogénèse pathologique
1) Angiogénèse
Nous n'évoquerons que l'angiogénèse de la DMLA (Dégénérescence Maculaire Liée à l'Age), mais le fonctionnement est comparable pour les autres néovaisseaux (cornéens, iriens...).
L'apparition des néovaisseaux est la conséquence d'une angiogénèse qui est sous l'influence de plus de 20 facteurs et principalement:
- le VEGF (Vascular Endothelial Growth Factor),
- les FGF (Fibroblast Growth Factors),
- les TGF-beta (Transforming Growth Factors),
- les EGF (Epidermal Growth Factors),
- les PDGF (Platelet-Derived Growth Factors),
- les IGF (Insulin-like Growth Factors),
- les TNF (Tumor Necrosis Factor alpha)
- l'IL8 (interleukine 8),
- et l'angiogénine.
L'action de l'angiogénèse est souvent bénéfique (ischémie cardiaque, renouvellement de l'endomètre...), mais parfois ce phénomène est nocif, comme dans la rétine, ou dans les fonctions d'alimentation des tumeurs cancéreuses. L'organisme réagit à l'ischémie qu'il enregistre, en essayant de créer de nouveaux vaisseaux pour alimenter les zones en déficit d'oxygène, mais cette réponse entraîne plus de complications que d'avantages. Les vaisseaux sont très fragiles et ont une forte tendance à saigner.
Le mécanisme de cette angiogénèse est assez complexe. On peut schématiquement distinguer 5 stades:
- l'ischémie tissulaire entraîne la production de VEGF qui est synthétisé par différentes cellules. C'est l'apparition du signal angiogénique.
- ce signal active les cellules inflammatoires qui vont libérer de nouveaux facteurs qui vont augmenter le signal angiogénique. Celui-là incite les cellules vasculaires endothéliales à produire des protéinases extracellulaires dont l'uPA (urokinase plasminogen activator) et plusieurs matrix métalloprotéinases (MMP). Ces enzymes détruisent la membrane basale qui entoure les cellulles endothéliales pour permettre leur migration. On différencie les métalloprotéinases en collagénases (MMP-1, MMP-8, MMP-13), les gélatinases (MMP-2, MMP-9) et les stromélisines (MMP-3, MMP-7, MMP-10, MMP-11).
- les cellules endothéliales migrent en nombre vers le signal angiogénique. Ce phénomène est intensifié par les fragments de protéines issues de la dégradation des parois de vaisseaux. Cette migration se fait par l'intermédiaire de molécules d'adhésion transmembranaires, les intégrines.
- elles prolifèrent pour former des néovaisseaux, les capillaires émanant des artérioles et des veinules vont se rejoindre pour former des anastomoses
- au dernier stade de l'angiogénèse une lumière apparaît dans le capillaire, permettant le passage du sang. Puis les cellules mésenchymateuses environnantes se différencient en péricytes. Une nouvelle membrane basale est enfin synthétisée autour du capillaire.
La régulation de l'angiogénèse est un équilibre fragile entre les facteurs qui induisent la naissance de nouveaux vaisseaux, et ceux qui inhibent ce processus (angiostatine et thrombospondine principalement).
Les pistes des nouveaux traitements comportent
- les anti-VEGF: l'aptamer et le Rhu-Fab
- les inhibiteurs des métalloprotéinases
- les inhibiteurs des intégrines
- l'acétate d'anecortave qui agit en amont, dans les cellules.
Nous ne parlerons pas des traitements abandonnés car apportant plus de problèmes que de bénéfices, comme la thalidomide.
2) L'aptamer
L'aptamer ou EYE001 du laboratoire Eyetech Pharmaceuticals, Inc., dont le nom commercial est Macugen (pegaptanib sodium) est un oligonucléotide anti-VEGF qui va se fixer sur le VEGF circulant pour éviter qu'il ne s'active et ne se lie au récepteur qui se situe sur la cellule endothéliale.
Cette molécule a montré une certaine activité dans des modèles in vitro et in vivo, bloquant les néovascularisations. Elle présenterait aussi une action contre les fuites vasculaires responsables des oedèmes maculaires du diabétique.
Ce traitement est délivré par des injections intravitréennes qu'il faut répéter au bout de quelques semaines. On envisage la mise en place d'implants intravitréens qui délivreraient le médicament pendant un laps de temps assez long, évitant les injections itératives.
Le 18 décembre 2002, la firme pharmaceutique Pfizer officialise une collaboration avec Eyetech Pharmaceuticals, et apporte 100 millions de $, et sans doute 195 millions supplémentaires plus tard.
Un essai de phase III est en cours, avec plus de 1200 patients répartis dans 117 services différents aux USA, au Canada, en Afrique du Sud, en Europe, en Israël et en Australie, le médicament étant utilisé en monothérapie ou bien associé à la photothérapie dynamique.
3) Le Rhu-Fab
Le RhuFab est un anticorps anti-VEGF du laboratoire Genentech qui va également se lier au VEGF pour bloquer son activité.
Ce traitement, encore en phase Ib/II, est également administré par des injections intravitréennes.
4) Les inhibiteurs des métalloprotéinases (MMP)
Les membranes néovasculaires expriment les MMP-9 et MMP-2. L'injection, dans le vitré du rat, d'inhibiteurs des métalloprotéinases inhibe la formation des néovaisseaux induits.
5) Les inhibiteurs des intégrines
On décrit les intégrines alpha v bêta 3 et alpha v bêta 5 qui jouent un rôle important dans l'angiogénèse. L'administration d'inhibiteurs de ces intégrines réduit la néovascularisation chez la souris.
6) L'acétate d'anécortave
Une voie est explorée par l'acétate d'anecortave du laboratoire Alcon, qui inhibe la migration des cellules endothéliales et leur prolifération. On l'a utilisé en collyre pour traiter les ptérygions avec des expérimentations animales tout à fait démonstratives.
Cette molécule, nommée initialement AL-3789, ressemble chimiquement à un corticoïde mais n'en a pas les propriétés.
Elle correspond à un stéroïde modifié qui, contrairement aux anti-VEGF, n'a pas d'action sur les sites d'action cellulaire du VEGF mais agit en aval de sa formation, à un niveau intracellulaire. Cela bloque la prolifération et la migration des cellules endothéliales.
La molécule
Sa formule est C23H30O5et elle a un poids moléculaire de 386.5.
Sa dénomination chimique est [4,9(11)-pregnadien-11bêta,17alpha,21-triol-3,20-dione-21-acetate].
Le groupe 11ß-OH (région [A] sur le schéma), indispensable pour l'activité glucocorticoide a été enlevé et une double liaison C9-C11 a été ajoutée (région [B]) pour éviter la réhydroxylation de C11. Un acétate a été ajouté en position C21 (région [C]), pour augmenter l'efficacité de la molécule.
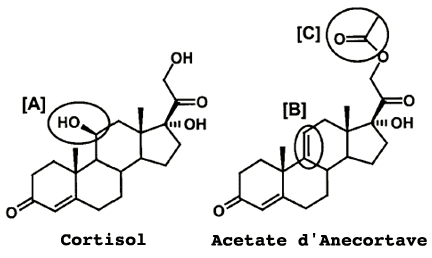
Schéma Dr S.Slakter
Mécanisme d'action
Il correspond à une inhibition de la croissance des cellules endothéliales (VEC=vascular endothelial cell), par inhibition de la synthèse des enzymes indispensables à la migration cellulaire.
L'anecortave évite le passage des cellules endothéliales à travers la membrane basale, dans le stroma alentours, en inhibant l'expression de la proforme inactive de la matrix métalloprotéinase-3 (proMMP) et de l'activateur urokinase-like du plasminogène (uPA), et en activant par ailleurs l'expression de l'inhibiteur de l'activateur du plasminogène (PAI).
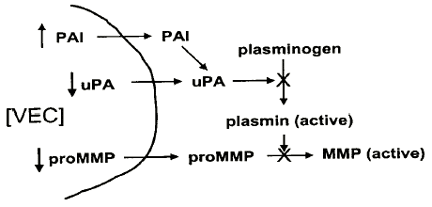
Schéma Dr S.Slakter
Clinique
L'acétate d'anécortave est un produit blanc, visqueux, qui nécessite des injections juxtasclérales tous les six mois. On obtient chez le lapin, 60% d'inhibition de la néovascularisation sous-rétinienne.
Le Professeur Gisèle Soubrane, rétinologue au Centre Hospitalier Universitaire de Créteil, France, évoquait en octobre 2002 au cours du Symposium EVER (European Association for Vision and Eye Research) à Alicante les résultats préliminaires d'un essai thérapeutique utilisant l'acétate d'anécortave.
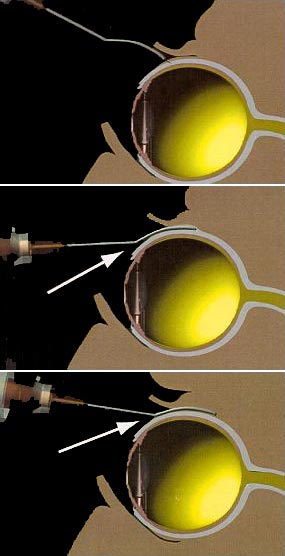
Des patients présentant des néovaisseaux maculaires à prédominance visibles, et ayant reçu 15mg d'acétate d'anécortave par voie juxtasclérale, avaient présenté significativement moins de baisse de la vision au bout de 12 mois que le groupe témoin qui n'avait reçu qu'un placebo. Pour administrer le produit, on crée, sous anesthésie locale, une petite ouverture dans la conjonctive et la capsule de Tenon pour glisser une canule (aiguille émoussée) le long de la sclère et injecter le produit derrière l'œil, en regard de la région maculaire. La durée d'action est de six mois, dit le Professeur Soubrane.
Source: Anecortave Acetate Administered as a Posterior Juxtascleral Injection for Subfoveal CNV in Age-Related Macular Degeneration (AMD) Clinical Results Gisèle Soubrane, MD. EVER, 2002
Pour confirmer ces résultats observés sur un relativement petit groupe de patients (128), un nouveau protocole de comparaison est en cours, qui évalue deux groupes de patients, le premier groupe recevant 15mg d'acétate d'anécortave, et un deuxième groupe recevant un placebo, c'est-à-dire un produit inactif utilisé comme comparateur. Le patient ne sait bien sûr pas dans quel groupe il se trouve.
Les patients retenus lors de la visite de sélection reviennent 10 jours plus tard pour l'injection du produit à l'étude (anécortave ou placebo), puis pour une visite de suivi à 3 mois. Six mois après la première injection, si la maladie est stable, une nouvelle injection est proposée. Au total 4 injections sont prévues sur 24 mois. Bien sûr à tout moment un patient peut interrompre sa participation. Un autre traitement approprié lui sera alors prescrit.
Environ 200 patients en Europe participeront à cet essai thérapeutique.
|
|
" C Regillo, DJ D'Amico, WS Mieler, C Schneebaum, C Beasley. Safety of Anecortave Acetate Administered as Posterior Juxtascleral Injection in Patients with Subfoveal Choroidal Neovascularization. " Document fourni par le laboratoire Alcon, provenant d'un poster de l'ARVO. |
7) Bibliographie
Clark AF, Mellon J, Li XY, Ma D, Leher H, Apte R, Alizadeh H, Hegde S, McLenaghan A, Mayhew E, D'Orazio TJ, Niederkorn JY. Inhibition of intraocular tumor growth by topical application of the angiostatic steroid anecortave acetate. Invest Ophthalmol Vis Sci. 1999 Aug;40(9):2158-62.
Clark Abbot F., Mellon Jessamee, Li Xiao-Yan, Ma Ding, Leher Henry, Apte Rajendra, Alizadeh Hassan, Hegde Sushma, McLenaghan Amanda, Mayhew Elizabeth, D'Orazio Thomas J., Niederkorn Jerry Y. Inhibition of intraocular tumor growth by topical application of the angiostatic steroid anecortave acetate IOVS Aug1999, Vol 40, number 9.
Clark Abbot F. AL-3789: a novel ophthalmic angiostatic steroid Exp. Opin. Invest. Drugs 1997 6(12):1867-1877
BenEzra David, Griffin Brenda W., Maftzir Genia, Sharif Najam A., Clark Abbot F. Topical formulations of novel angiostatic steroids inhibit rabbit corneal neovascularization Investigative ophthalmology & Visual Science, sept 1997, vol 38 num 10.
Enaida H, Ito T, Oshima Y, Sakamoto T, Yago K, Kato K, Kochi H. Effect of growth factors on expression of integrin subtypes in microvascular endothelial cells isolated from bovine retinas. Fukushima J Med Sci. 1998 Jun;44(1):43-52.
Friedlander M, Theesfeld CL, Sugita M, Fruttiger M, Thomas MA, Chang S, Cheresh DA. Involvement of integrins alpha v beta 3 and alpha v beta 5 in ocular neovascular diseases. Proc Natl Acad Sci U S A. 1996 Sep 3;93(18):9764-9.
Luna J, Tobe T, Mousa SA, Reilly TM, Campochiaro PA. Antagonists of integrin alpha v beta 3 inhibit retinal neovascularization in a murine model. Lab Invest. 1996 Oct;75(4):563-73.
McNatt Loretta G., Weimer Lori, Yanni John Yanni, Clark Abbot F. Angiostatic Activity of steroid in the chick embryo cam an rabbit cornea models of neovacularization Alcon laboratories, Inc., Fort Worth, Texas Journal of ocular pharmacology and therapeutics Volume 15, number 5, 1999.
Penn JS, Rajaratnam VS, Collier RJ, Clark AF. The effect of an angiostatic steroid on neovascularization in a rat model of retinopathy of prematurity. Invest Ophthalmol Vis Sci. 2001 Jan;42(1):283-90.
Riecke B, Chavakis E, Bretzel RG, Linn T, Preissner KT, Brownlee M, Hammes HP. Topical application of integrin antagonists inhibits proliferative retinopathy. Horm Metab Res. 2001 May;33(5):307-11.
Rifkin DB, Gross JL, Moscatelli D, Gabrielides C. The involvement of proteases and protease inhibitors in neovascularization. Acta Biol Med Ger. 1981;40(10-11):1259-63.
Stromblad S, Fotedar A, Brickner H, Theesfeld C, Aguilar de Diaz E, Friedlander M, Cheresh DA. Loss of p53 compensates for alpha v-integrin function in retinal neovascularization. J Biol Chem. 2002 Apr 19;277(16):13371-4.
Takagi H, Suzuma K, Otani A, Oh H, Koyama S, Ohashi H, Watanabe D, Ojima T, Suganami E, Honda Y. Role of vitronectin receptor-type integrins and osteopontin in ischemia-induced retinal neovascularization. Jpn J Ophthalmol. 2002 May-Jun;46(3):270-8.
Taylor CM, Weiss JB, Kissun RD, Garner A. Effect of oxygen tension on the quantities of procollagenase-activating angiogenic factor present in the developing kitten retina. Br J Ophthalmol. 1986 Mar;70(3):162-5.