Le site des ophtalmologistes de France
Encyclopédie de la vue
Vous êtes ici
Matériovigilance: des implants s'opacifient
Matériovigilance en ophtalmologie
Medical devices vigilance system
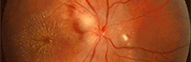
Exemple: Un implant cristallinien opaque
Un implant cristallinien devenu opaque

Implant cristallinien devenu opaque
Cliché Dr Jacques Vigne St Nicolas Toulouse France
Certains implants cristalliniens, mis en place au cours d'une intervention de cataracte, deviennent opaques. L'acuité visuelle diminue alors rapidement et il faut de nouveau opérer le patient pour changer l'implant de mauvaise qualité (c'est une explantation). Ce type de complication est heureusement rare. Pour diminuer ce risque, les ophtalmologistes font une déclaration au Ministère de tout problème survenu au cours ou à la suite d'une intervention chirurgicale, ou lors de l'utilisation d'un dispositif médical quelconque. C'est la matériovigilance.
Une commission de matériovigilance reçoit les différentes déclarations et va proposer des interdictions temporaires ou définitives des différents dispositifs médicaux mis en cause.
La matériovigilance
La matériovigilance a pour objet la surveillance des incidents ou des risques d'incidents résultant de l'utilisation des dispositifs médicaux après leur mise sur le marché. Elle comporte:
- le signalement des incidents ou des risques d'incidents
- l'enregistrement, l'évaluation et l'exploitation des informations signalées, dans un but de prévention
- la réalisation de toutes études ou travaux concernant la sécurité d'utilisation de dispositifs médicaux
- la réalisation et le suivi des actions correctives décidées.
La matériovigilance est régie par la loi n° 94-43 du 18 janvier 1994 relative à la santé publique et à la protection sociale, modifiée par la loi 95-116 du 4 février 1995 portant diverses dispositions d'ordre social, et les décrets 95-292 du 16 mars 1995 relatif aux dispositifs médicaux et 96-32 du 15 janvier 1996 relatif à la matériovigilance exercée sur les dispositifs médicaux, dispositions codifiées aux articles L.665-6 et R.66548 à R.665-64 du code de la Santé Publique.
Ces textes transposent en droit français les directives de la commission des communautés européennes 90/385/CEE du 20 juin 1990 et 93/42/CEE du 14 juin 1993.
La déclaration d'incidents et d'accidents
Tout incident ou risque d'incident dès lors qu'il est associé à l'utilisation d'un dispositif médical doit conduire à s'interroger sur la nécessité de le signaler à l'autorité administrative.
On entend par dispositif médical tout instrument, appareil, équipement, matière, produit, à l'exception des produits d'origine humaine, ou autre article seul ou en association, y compris les accessoires et logiciels intervenant dans son fonctionnement, destiné par le fabricant à être utilisé chez l'homme à des fins médicales et dont l'action principale voulue n'est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, mais dont la fonction peut être assistée par de tels moyens.
On doit déclarer obligatoirement et sans délai les incidents ou risques d'incidents ayant entraîné ou susceptibles d'entraîner la mort ou la dégradation grave de l'état de santé d'un patient, d'un utilisateur ou d'un tiers.
Qui doit déclarer ? Toute personne, fabricant, utilisateur ou tiers faisant la constatation ou ayant connaissance d'incidents ou de risques d'incidents mettant en cause un dispositif médical. Sont considérées comme des tiers, les personnes qui ne sont ni des fabricants ou des utilisateurs, ni des patients.
On doit déclarer auprès du correspondant local de matériovigilance lorsque les signalements d'incidents ou de risques d'incidents sont effectués par des utilisateurs ou des tiers qui exercent leurs fonctions dans un établissement de santé ou dans une association distribuant des dispositifs médicaux à domicile, notamment lorsque ces utilisateurs ou tiers sont des membres des professions de santé ou des membres du personnel administratif ou technique. Le correspondant local de matériovigilance transmet les signalements à l'autorité administrative.
Directement, auprès de l'autorité administrative de la santé dans les autres cas, en particulier lorsque les signalements sont effectués par des professionnels de santé exerçant à titre libéral et par les fabricants ou leurs mandataires, grâce au fichier pdf de l'afssaps
à envoyer à:
Agence Française de Sécurité Sanitaire des Produits de Santé (afssaps)
Unité Matériovigilance
143 / 147 bd Anatole France
93285 ST DENIS CEDEX
fax 01.55.87.37.02
Conclusion
En 2000, deux catégories d'implants cristalliniens ont été retirées du marché à cause de leur opacification progressive.
Voilà ce que dit le bulletin numéro 8 (octobre-décembre 2001) de l'Afssaps:
numéro 8 (octobre-décembre 2001) de l'Afssaps:
"... Depuis 1999, 93 incidents ont été signalés à l'Afssaps, dont 37 ont conduit à une explantation. Ce nombre croit de mois en mois et de nouvelles opacifications sont signalées régulièrement. Ces implants présentent des dépôts phosphocalciques dans la zone optique au sein du matériau. Bien que ces produits aient été suspendus, ces faits nous amènent à attirer l'attention des correspondants de matériovigilance sur l'intérêt de continuer à signaler, à des fins statistiques, les incidents de perte d'acuité visuelle ou anomalies liées à la présence de ces implants."
La matériovigilance permet ainsi de limiter le nombre d'incidents et d'accidents dus à des dispositifs médicaux.
Liens
Complications of cataract and refractive surgery: a clinicopathological documentation
Bibliographie
Apple David J., MD, Werner Liliana, MD, PhD Complications of cataract and refractive surgery: a clinicopahological documentation. Tr. Am. Ophth. Soc. Vol. 99, 2001
Fernando GT, Crayford BB. Visually significant calcification of hydrogel intraocular lenses necessitating explantation. Clin Experiment Ophthalmol. 2000 Aug;28(4):280-6.
Frohn A, Dick HB, Augustin AJ, Grus FH. Late opacification of the foldable hydrophilic acrylic lens SC60B-OUV. Ophthalmology. 2001 Nov;108(11):1999-2004.
Groh MJ, Schlotzer-Schrehardt U, Rummelt C, von Below H, Kuchle M. [Postoperative opacification of 12 hydrogel foldable lenses (Hydroview(R))] Klin Monatsbl Augenheilkd. 2001 Oct;218(10):645-8. German.
Nicula C, Nicula D. [The explantation and implantation of artificial crystalline lenses] Oftalmologia. 2000;51(2):14-8. Romanian.
Shek TW, Wong A, Yau B, Yu AK. Opacification of artificial intraocular lens: an electron microscopic study. Ultrastruct Pathol. 2001 Jul-Aug;25(4):281-3.
Li S, Liu Y, Yang W, Li H, Lin Z. [Outpatient intraocular lens implantation] Yan Ke Xue Bao. 1991 Jun;7(2):70-3. Chinese.