Séquence d'une intervention de ptérygion
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nous remercions les Laboratoires Villanova pour leur coopération et leur iconographie,
ainsi que les patients qui ont donné leur accord.
Les progrès de la chirurgie ophtalmologique actuelle entraînent de moins en moins "d'oeil perdu".
Le nombre d'éviscération (on enlève l'intérieur de l'oeil et on ne garde que la sclére), d'énucléation (on enlève l'oeil) ou d'exentération (on enlève tout le contenu de l'orbite), diminue donc.
Malgré tout il arrive que des accidents de la vie quotidienne aboutissent à la perte fonctionnelle de l'oeil : celui ne fonctionne plus et a souvent un aspect peu esthétique. Le problème se pose aussi avec certaines maladies (herpès oculaire, uvéite grave, glaucome non traité...)
Ce sera alors le rôle de l'oculariste d'équiper le patient avec une prothèse à but esthétique; celle-ci permettra une vie sociale normale et le patient ne sentira plus le regard de l'entourage sur cet oeil blanc et dévié qui ne lui sert plus à rien.
Il existe en France 20 ocularistes répartis dans les différentes régions qui ont donc le rôle d'accueillir ces patients monophtalmes: ils vont prendre l'empreinte de la cavité orbitaire, des photos de l'oeil adelphe pour pouvoir reproduire la même couleur sur la prothèse.
On peut décrire trois type d'appareillage : le verre scléral, les prothèses mobiles sur implants "corail" et les épithèses :
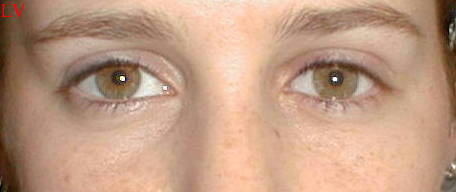 Verre scléral en place (traumatisme gauche) |
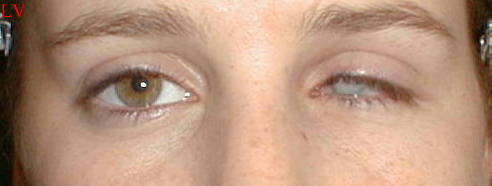 Aspect avant la pose du verre scléral |
Parfois il est nécessaire d'équiper des enfants :
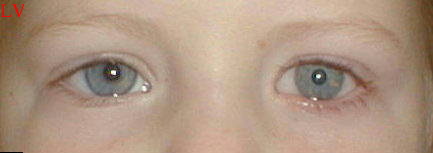 Verre scléral en place (microphtalmie gauche) |
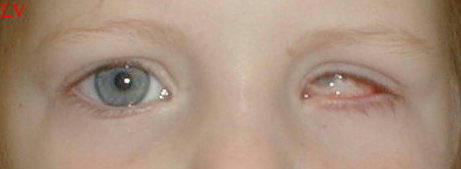 Aspect avant la pose du verre scléral |
et quelques liens...
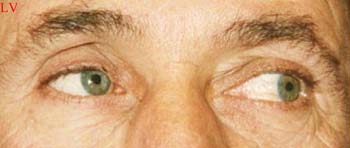 Bonne mobilité de la prothèse droite |
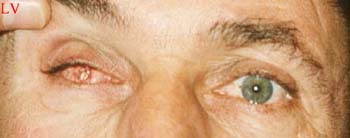 Aspect avant la pose de la prothèse corail |
 |
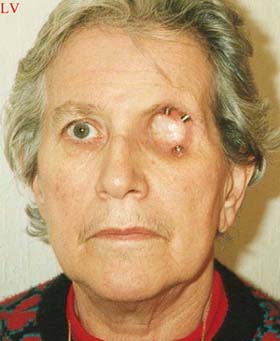 |
Ces prothèses sont prises en charge par les Caisses d'Assurance Maladie :
TIPS :
Quelques liens :
ADEF (Epithèse.Prothèse faciale)
Worldoc: World Online Directory of Ocular Prosthetic Makers
American Society of Ocularists
National Examining Board of Ocularists Inc.(NEBO)
Nous vous proposerons d'autres éléments dans le premier trimestre 2000.
Préparation et conditionnement de la membrane amniotique délivrée par la banque de tissu de l'AP-HP..
Nous remercions beaucoup l'équipe de l'Hotel-Dieu (Pr Legeais, 1 Place du Parvis Notre-Dame. Paris. 75004 France) qui a fourni les documents pour réaliser ce chapitre.
La greffe de membrane amniotique (MAH) est un nouveau traitement chirurgical des maladies inflammatoires de la cornée.
Dans ces pathologies de surface cornéenne, il existe une destruction progressive de l'épithélium cornéen (surface de la cornée) avec son remplacement. par un épithélium anormal de type conjonctival associé à une vascularisation et une inflammation chronique faisant perdre sa transparence au tissu cornéen.
Dans ces conditions, une kératoplastie transfixiante ( greffe de cornée classique) est vouée à l'échec et ne doit pas être utilisée car les phénomènes inflammatoires actifs empêchent la cicatrisation.
La maladie est essentiellement à la surface de la cornée et respecte le reste de sa structure-, il n'y a donc aucune raison d'envisager un remplacement complet de la cornée par une cornée artificielle. C'est entre ces deux indications que se situe la greffe de MAH. La greffe de MAH permet d'apporter une structure avasculaire et acellulaire jouant le rôle de membrane basale ( support à l'épithélium) limitant le phénomène inflammatoire chronique, la vascularisation cornéenne et facilitant la cicatrisation épithéliale.
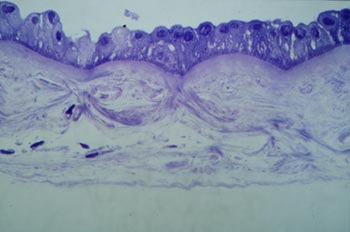
Coupe histologique d'une membrane amniotique après conservation pendant 3 mois à -80°c.
L'épithélium peut être enlevé avant utilisation par simple grattage de la membrane.
Cette greffe est aujourd'hui possible dans notre pays grâce à la constitution d'une filière assurant la collection, la préparation et la distribution de ces membranes. Cette greffe peut être aujourd'hui proposée comme traitement chirurgical des pathologies oculaires de surface. La réglementation qui s'applique aux greffes de membrane amniotique est celle de la greffe cornée. Une demande de remboursement de ces membranes a officiellement été déposée auprès de la sécurité sociale.
L'utilisation de membranes amniotiques est ancienne, puisqu'on les avait utilisées en chirurgie générale dès 1950; les premiers essais avaient été réalisés en 1910.
En ophtalmologie il fallut attendre 1940 pour que De Roth les utilise dans des altérations conjonctivales.
Les premières études cliniques ont été rapportées récemment aux USA, au Bascon-Palmer Eye Institute de Miami par le Professeur S.C.G. Tseng, puis au Japon. Elles furent utilisées isolément ou associées à des allogreffes limbiques.
Cette greffe est aujourd'hui possible en France grâce à la constitution d'une filière Française constituée au sein de l'AP-HP. La première greffe a été réalisée en France a l'Hôtel-Dieu de Paris le 10 novembre 1999. Les prélèvements sont actuellement réalisés à la maternité de Port Royal par l'équipe du Pr. D. Cabrol. Ils sont traités et conservés pendant quatre mois à la banque de tissu de l'Assistance Publique des hôpitaux de Paris (Hôp. Saint-Louis). Les greffes et le suivi post opératoire sont assurés actuellement à l'Hôtel-Dieu de Paris.
La greffe de MAH facilite la cicatrisation épithéliale avec une excellente tolérance clinique du fait de sa faible immunogénicité. Les membranes amniotiques (MAH) peuvent être associées à des autogreffes ou allogreffes de limbe dans le traitement des pathologies cornéennes de surface.
Les placentas sont recueillis après avoir obtenu un consentement éclairé de la patiente et exclusivement après délivrance par césarienne programmée d'un enfant normal et en bonne santé (directive 98/44/CE du 6/7/98, décret 97-928 du 9/10/97, décret 99-741 du 30/8/99).
Les placentas prélevés sont acheminés dans un conditionnement stérile vers la banque de tissu de Saint-Louis. Les membranes amniotiques sont préparées sous hotte à flux laminaire et conservées par cryocongélation pendant 3 mois. Cette quarantaine nécessaire permet un second contrôle de la séronégativité des femmes donneuses.
Le placenta est rincé en condition stérile à l'aide d'une solution saline contenant 50µg/mI de pénicilline, 50µg/mI de streptomycine, 100 µg/mI de néomycine et 2.5 µg/mI d'amphotéricine B. La membrane amniotique est alors détachée du chorion et apposée sur une membrane en nitrocellulose de telle sorte que la face épithéliale soit vers le haut.
La membrane est ensuite préparée en rectangle de 3 cm sur 4 cm. Elles sont ensuite conservées avant transplantation dans une solution stérile contenant 50% de DMEM ( Dulbecco's modified essential medium) et 50% de glycérol et placées à -80°c.
Tout au long de ces préparations on réalisera des contrôles bactériologiques et histologiques.
Avant utilisation, les membranes sont placées à température ambiante pendant environ 30 minutes. Elles sont retirées de leur milieu de conservation toujours posées sur filtre de nitrocellulose et greffées. On peut obtenir environ 30 greffons de 3 cm sur 4 cm à partir d'une seule membrane.
Toutes ces étapes permettent une traçabilité parfaite des membranes.
Les principales indications des greffes de MAH sont:
On estime à 500 par an le nombre de patients pouvant bénéficier de ce traitement, en France.

Décongélation de la membrane sur filtre de nitrocellulose avant son utilisation
La greffe de membrane amniotique peut être utilisée isolément et également comme chirurgie préparatoire à une greffe de cornée pour en améliorer le pronostic et diminuer les risques de rejet.
La chirurgie peut se faire sous anesthésie locale ou générale. Après avoir retiré le voile conjonctivo-vasculaire opacifiant la cornée, un patch de MAH est découpé avant d'être posé en regard des lésions et débordé légèrement la zone pathologique sur 360°. La suture se fait au Nylon 10.0.
En cas de destruction sévère du limbe, la greffe de membrane amniotique doit être associée systématiquement à une autogreffe ou à une allogreffe limbique nécessitant dans ce dernier cas l'utilisation de Ciclosporine en goutte ou per os.
Le traitement post opératoire est un traitement local associant le plus souvent un corticoïde ( acétate de prednisolone) et un antibiotique. Les posologies initiales sont élevées, 1 goutte toutes les heures avec une décroissance progressive sur un mois. Les fils sont retirés au bout de trois semaines environ.
Il reste un peu mystérieux et complexe, mais on sait que les MAH ont une action régulatrice de la cicatrisation épithéliale et de l'inflammation stromale.
L'épithélium sera détruit par la congélation, la lame basale est épaisse, la matrice stromale est avasculaire et on ne retrouve pas d'antigènes leucocytaires donc les rejets sont quasi inexistants.
La greffe de membrane amniotique est aujourd'hui possible en France et est diffusée depuis février 2000 dans les centres hospitaliers et les centres privés.
De Roth A. Plastic repair of conjunctival defects with fetal membranes. Arch Ophthalmol 1940; 23: 522-5.
Choi YS, Kim JY, Wee WR, Lee JH. Effect of the application of human amniotic membrane on rabbit corneal wound healing after excimer laser photorefractive keratectomy. Cornea 1998; 17:389-95.
Subrahmanyam M. Amniotic membrane as a cover for microskin grafts. Br j Plast Surg 1995; 48: 477-8.
Prabhasawat P, Tseng SC. Impression cytology study of epithetial phenotype of ocular surface reconstructed by preserved human amniotic membrane. Arch Ophthalmol. 1997; 115 : 1360-7.
Shimazaki J, Yang HY, Tsubota K. Amniotic membrane transplantation for ocular surface reconstruction in patients with chemical and thermal burns. Ophthalmology 1997; 104. 2068-76.
Shimazaki J, Shinozaki N, Tsubota K. Transplantation of amniotic membrane and limbal autograft for patients with recurrent pterygium associated with symblepharon. Br j Ophthalmol 1998; 82 : 235-40.
Tseng SC, Prabhasawat P, Barton K, Gray T, Meller D. Amniotic membrane transplantation with or without limbal allografts for corneal surface reconstruction in patients with limbal stem cell deficiency. Arch Ophthalmol 1998; 116:431-41.
Tseng SC, Prabhasawat P, Lee SH. Amniotic membrane transplantation for conjunctival surface reconstruction. Am J Ophthalmol 1997; 124 : 765-74.
Lee SH, Tseng SC. Amniotic membrane transplantation for persistent epithelial defects with ulceration. Am j Ophthalmol 1997. 123 :303-12.
Legeais JM. Greffe de membrane amniotique sur la cornée : une première en France. Les cahiers d'ophtalmologie. Janvier 2000 :7-9.
Honavar SG, Bansal AK, Sangwan VS, Rao GN. Amniotic membrane transplantation for ocular surface reconstruction in Stevens-Johnson syndrome. Ophthalmology. 2000 May;107(5):975-9.
Messmer EM, Hintschich CR, Partscht K, Messer G, Kampik A. Ocular cicatricial pemphigoid. Retrospective analysis of risk factors and complications. Ophthalmologe. 2000 Feb;97(2):113-20. Allemand.
Tan D. Conjunctival grafting for ocular surface disease. Curr Opin Ophthalmol. 1999 Aug;10(4):277-81..

Nous remercions les Dr Claude et Joseph Léon qui ont fourni l'ensemble des éléments permettant de présenter cette technique d'exploration et d'intervention chirurgicale.
Ce travail a pour but d'initier aux bases d'endoscopie tous les ophtalmologiste intéressés par cette approche originale diagnostique et thérapeutique. L'ophtalmologie sera obligatoirement endoscopique : l'endoscopie va peu à peu s'installer dans tous les les blocs opératoires d'ophtalmologie, se couplant harmonieusement au microscope opératoire, complémentairement indispensable.
|
|
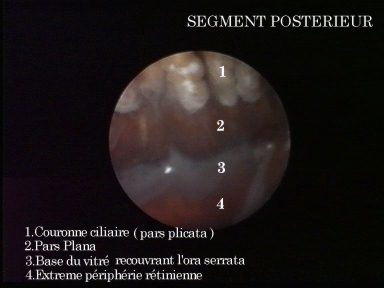
<= Vallées et procès (Pars plicata)
<= Plis et stries (Pars plana)
<= Baies et dents (Ora serrata) |
L'endoscopie en ophtalmologie est une discipline naissante. Les ophtalmologistes la connaissent encore peu pour de multiples raisons.
En premier lieu parce que l'usage du microscope opératoire -à lui seul - donne déjà à l'opérateur l'impression d'avoir atteint les limites de la perfection en matière de contrôle interventionnel : en effet, il s'est doté des dernières technologies optiques permettant d'avoir une qualité d'image inégalable, de multiples motorisations le rendant plus convivial, d'adaptateurs vidéoélectroniques, d'inverseurs d'images, de filtres lasers, de commandes vocales, et de nombreux autres additifs.
Dès la fin de l'été 1984, au retour du congrès d'Harrogate de la sociéte européenne d'implantation, nous nous sommes intéressés à l'espace rétro-irien. Qui pouvait s'intéresser à une telle "zone d'ombre": puisque le microscope opératoire ne pouvait l'atteindre, cela devait signifier qu'elle n'avait pas d'importance.
Des milliers d'anses d'implants postérieurs croisaient le bord pupillaire pour rejoindre "au hasard de leur glissement" une partie invisible de l'espace rétro-irien. Il y avait un angle mort, une zone aveugle que l'impossibilité d'observer -à l'époque- semblait rendre futile et sans intérêt.
Quand nous y pénétrâmes la première fois, nous en fûmes tellement éblouis que l'image du microscope opératoire nous parut fade en comparaison, peut-être parce que toute l'imagerie que nous offrait l'observation endoscopique était nouvelle (les procès ciliaires, la zonule et l'équateur cristallinien, la pars plana, la base du vitré et la rétine ), mais surtout parce que nous pressentions que la virginité du sujet était telle qu'elle laissait présager une aussi bouleversante révolution pour l'ophtalmologie que celle du microscope opératoire vingt ans plus tôt.
Deux évidences s'imposèrent à nous d'emblée.
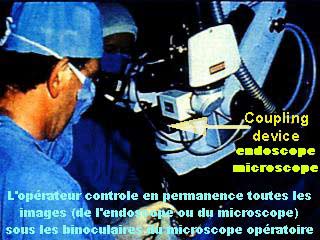
D'une part, l'endoscopie devait être étroitement unie au microscope opératoire pour former avec lui un ensemble indissociable et complémentaire : au microscope l'examen frontal, à l'endoscope l'observation sagittale.
D'autre part, toute la technologie d'approche intra-oculaire devait être soigneusement adaptée à l'ophtalmologie et ne pouvait se concevoir comme une pâle copie empruntée aux autres spécialités endoscopiques (comme l'orl, l'orthopédie, la gastro-entérologie, ou la neuro-chirurgie).
L'ophtalmologie endoscopique nécessitait le développement de la microendoscopie (endoscopes voisins de 1 mm, léon-efer-storz) et de son couplage au microscope opératoire ( appelé "système endomicroscope", ou comment observer les images endoscopiques à travers le binoculaire du microscope opératoire, (léon-institut d'optique de Paris). Enfin, travaux sur la lumière d'éclairage (jacques vulmiere-léon école supérieure d'optique Paris ) et sur le couplage aux lasers (léon-société française de lasers médicaux ).
La microchirurgie endoscopique, ou endoscopie microchirurgicale était née : il ne lui restait plus qu'à grandir, avec l'opiniâtreté de tous et l'opportunité des progrès technologiques.
Les ainés pionniers nous ont toujours entourés de leur confiance et encouragements, parfois fait de rencontres informelles, souvent d'une proximité relationnelle : d. Aron-rosa, c.d. Kelman, k. Miyake, a.Galand, r. Lindstrom, m.Blumenthal, l.Buratto, g. Coscas, j.Haut, ph. Sourdille, f.Fankhauser, a. Ditmar, p.De Laage, etc.
Le courant endoscopique international en ophtalmologie s'installe progressivement : m.Uram, s.Eguchi, d. Bremond-gignac, k. Joos, y. Fisher, c.Boscher, j.Alvarado, j.Gayton, p.Rol, n.b. Medow, etc.
Préambule
La majorité des matériels cités ne sont pas encore commercialisés, en phase de projet avancé pour grand nombre d'entre eux. Si à l'heure actuelle, il est difficile pour un opérateur de trouver l'éventail de produits nécessaires, il aura bientôt l'embarras du choix. Autour des années 1980, il n'était pas aisé de trouver un phacoémulsificateur. Aujourd'hui…
Nous conseillons donc vivement aux intéressés de ne rien précipiter dans leurs choix présents.
Le matériel endoscopique se compose de trois composants :
=> l'endoscope
=> l'endomicroscope ( élément de couplage endoscope-microscope)
=> le matériel annexe
Il est rigide : bien que ce terme soit le plus souvent réservé aux endoscopes constitués de micro-lentilles additionnelles, cela est différent en microendoscopie car la sonde est habitée simplement par une tige de verre conductrice de l'image (ou "selfoc"), entourée de fibres optiques d'éclairage (coaxial).

L'oculaire (oeilleton) est réporté à 1mètre de la pièce à main elle-même, afin de libérer l'espace de travail, et permettre sa connectique au microscope opératoire.

Certains le connectent directement à l'objectif d'une caméra, réalisant ainsi une vidéoendoscopie. Cette méthode n'est pas adaptée à la pratique endoscopique en microchirurgie (dangereux perte de controle du champ opératoire lorsque l'opérateur regarde l'écran vidéo "endoscope en position intra-oculaire").
Par contre il est vivement recommandé d'utiliser un ensemble optronique ( endoscope constitué d'un objectif optique et d'un corps d'oculaire électronique de type CCD intégré) pour recueillir une image de meilleure qualité tout en requérant beaucoup moins de lumière d'éclairage : cet endoscope optronique sera connecté directement à l'endomicroscope pour permettre de travailler sur une image électronique directement à travers le binoculaire du microscope opératoire.
Tous les microendoscopes sont d'ailleurs réalisés sur le même principe de base : wolf, olympus, storz, …et sont tous adaptables à l'endomicroscope.
Les microendoscopes peuvent être purement optiques (image optique, transmission optique), ou optronique (image optique transmise de maniere électronique). Peut-être pourront-ils être bientôt "tout électronique" ( nécessitant alors un capteur ccd comme objectif, prouesse technologique pour 1 mm de diamètre ).
L'important n'est pas tant le moyen physique utilisé que le résultat, la qualité de l'image endoscopique. Le microchirurgien est trop habitué a l'excellence de l'imagerie du microscope opératoire pour se contenter d'images endoscopiques médiocres.
L'endomicroscope s'intercale entre les oculaires et l'objectif du microscope.

Tous les microscopes sont connectables, méritant chacun une pièce spécifique de couplage (moller-wedel, zeiss, wild, topcon, …)
L'opérateur se trouve ainsi confiné "dans un ensemble de champs d'observation sous contrôle permanent dans les binoculaires du microscope opératoire", champs choisis à sa convenance en fonction des nécessités interventionnelles, soit frontal (axial) pour le champ microscope, soit sagittal (latéral) pour le champ endoscopique.
Les générateurs de lumiere froide au xénon 300 watts sont conseillés, avec variateur de puissance à la demande.
Les conducteurs les mieux adaptés sont des cables dont le contenant est un liquide, permettant d'augmenter de 30% environs la transmission de lumière.
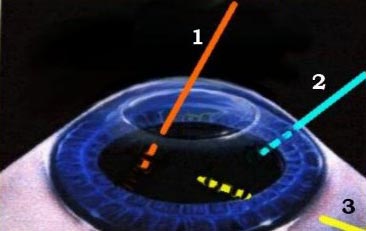
L'abord endoscopique peut se faire soit en segment antérieur, soit postérieur.
Le plus souvent, l'endoscope emprunte les voies d'abord d'instruments antérieurs (sonde phaco, micromanipulateur, canule d'irrigation, …), ou postérieurs (vitréotome, sonde d'endoillumination, …).
Cependant, un certain nombre d'indications imposent à l'endoscope une voie d'abord sélective (glaucomes réfractaires, CEIO, …)
En segment postérieur, l'endoscopie rend le plus souvent obsolète l'utilisation de la sonde d'endoillumination remplacée judicieusement par le seul éclairage de l'endoscope : il est inutile de multiplier les sources d'éclairage intra-oculaires simultanément.
Plus l'abord endoscopique sera antérieur, plus l'obliquite de l'axe interventionnel d'observation de l'endoscope sera important.
Trois abords principaux peuvent être définis :
L'endoscope est toujours introduit éteint afin de minimiser les temps d'exposition de la lumiere d'éclairage. Il est souvent précédé en segment antérieur d'injection de substance visco-élastique pour avoir un espace d'examen bien dilaté, respectant mieux les contraintes de distance focale qu'exige la microendoscopie.
L'introduction intra-oculaire de l'endoscope, ses déplacements et sa situation exacte à tous moments de l'intervention sont contrôlés par le microscope opératoire. La commutation "endoscopique", avec mise en fonction de la lumière d'éclairage de l'endoscope (système"endomicroscope", cf matériel) permet l'observation du champ d'examen endoscopique "toujours sous binoculaire du microscope opératoire"). L'opérateur passera ainsi en permanence de la vision des champs d'observation du microscope opératoire (axial), à ceux de l'endoscope (sagittal). L'apprentissage du "réflexe de défocalisation", l'arrêt automatique d'éclairage endoscopique en commutation "microscope", et le liquide d'irrigation-refroidissement de sonde en cours d'examen endoscopique permettent d'éviter les risques de phototraumatismes par la lumière d'éclairage endoscopique.
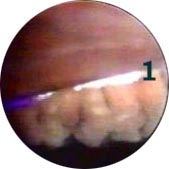
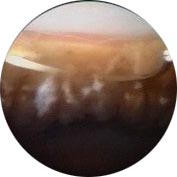
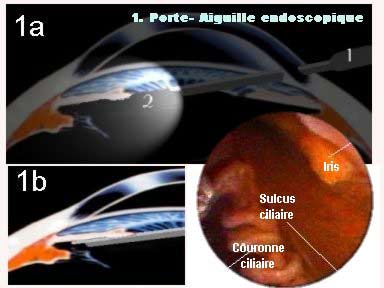
L'examen endoscopique permet de définir une entité antomo-endoscopique sagittale appelée l'angle cornéo-ciliaire, divisé horizontalement par le rideau irien en 2 parties antérieur ou pré-irien et postérieur ou rétro-irien.
Notons que la racine de l'iris s'insère sur le muscle ciliaire le séparant en deux élements, antérieur ou bande ciliaire, et postérieur ou sulcus ciliaire.
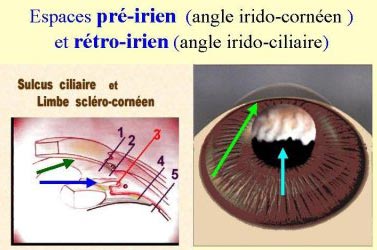
L'angle cornéo-ciliaire présente d'avant en arrière :
a) Cataracte et endoscopie
Cinq indications principales, non exhaustives, méritant chacune un développement tout particulier :
1.Contrôle de position des anses d'implants postérieurs
 Implant postérieur dans le sulcus ciliaire |
 Implant postérieur luxé en avant de la couronne cilaire |
2.Examen de la péripherie de la chambre postérieure : reliquats corticaux, éléments vitréens, sang,. …
Cet examen sera d'autant plus justifié qu'il existe une fermeture pupillaire.
C'est aussi la meilleure qualité du nettoyage vitréen antérieur qui réduira les complications rétiennes secondaires.
3.Observation précise du site de suture au sulcus en cas d'implantation postérieure suturée, soit au cours de phaco compliquée d'accident vitréen, soit au cours d'implantation secondaire avec ou sans kératoplastie perforante.
4.Analyse de la situation de l'anneau de tension du sac : cela permettra d'avoir la certitude objective qu'une partie de cet anneau ne se soit introduit dans une brèche capsulo-zonulaire, et ne compromette la suite de l'intervention.
5. Implantation postérieure suturée : si l'indication de suture d'implant postérieur est posée, elle doit se faire "ab-interno et sous contrôle endoscopique permanent". Le contrôle parfait du site de perforation interne de l'aiguille, idéalement au sulcus, ne peut se faire que grâce à l'endoscopie. Toutes les autres méthodes, ab-externo ou ab-interno sans contrôle sont totalement "aveugles" et exposent aux complications graves des fausses routes antérieures " iriennes ) ou postérieures ( base du vitré, rétine )
b) Glaucome et endoscopie
Un certain nombre de méthodes chirurgicales sont utilisables pour intervenir sur les deux sites, de sécrétion ou d'évacuation : méthodes ab-externo actuellement les plus courantes, et méthodes ab-interno, plus récentes car étroitement dépendantes des moyens d'observation per-opératoires (endoscopiques).
L'endoscopie par ses capacités d'abord sagittal permet le contrôle parfait pré ou rétro-irien de tous les sites fonctionnels d'action " tensionnel ". Aux indications ab-externo, non invasives pour la plupart, mais très souvent " aveugles " (cyclodestuction transclérale) s'ajoutent les indications ab-interno, invasives (le plus souvent minimalement), mais autorisant un contrôle endoculaire parfait du site d'action :
*angle irido-cornéen, centré sur le trabeculum
*et l'angle irido-ciliaire, centré sur la couronne ciliaire.
Plusieurs méthodes peuvent être appliquées. Certaines telle la cyclophotocoagulation ou la goniotomie sont largement validées, d'autres encore embryonnaire méritent un recul suffisant pour l'être :
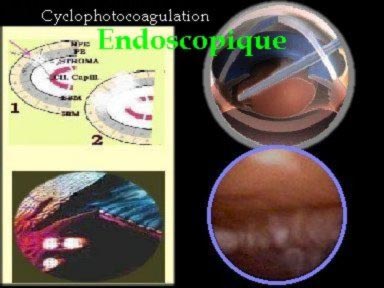
L'endoscope contrôle l'action qualitative et quantitative de l'action laser sur les procès : ni surdosage ou sous-dosage (puissance du laser parfaitement adaptée), pas de fausses routes ( précision des impacts sur la tête ou les versants des procès).
La fibre laser est coaxiale à l'endoscope. La longueur d'onde peut être celle d'un ktp (532 nm), soit celle d'un semi-conducteur (810 nm). La préférence ira au second car le filtre n'aura pas de caractéristique spectrale dans le "visible" beaucoup plus contraignant pour le rendu de l'image endoscopique ( ex. laser KTP)
C'est l'épithelium pigmenté du procès qui absorbe la plus grande partie du rayonnement (site d'action électif). La diffusion thermique se fait ensuite par contiguité vers les couches de l'épithélium non-pigmenté, vers les membranes basales internes et externes, et vers les capillaires ciliaires du stroma ciliaire. Ainsi, le procès est détruit, réduisant considérablement sa valeur fonctionnelle sécrétante.
L'action efficace se manifeste par un intense blanchiment, et une contraction tissulaire, sans dispersion pigmentaire ni bulles de vaporisation (signes de surdosage).
90 a 110° de couronne ciliaire est ainsi traitée.
Idéal sur oeil aphake...juste après phaco et avant implantation.
Comparer avantages et inconvénients des méthodes ab-interno contrôlées et ab-externo "aveugles" telles les cyclophotocoagulations transclérales.
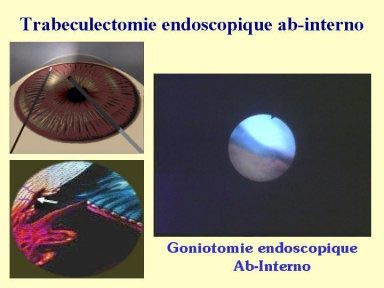
Morton W. Grant (1954-1957) fut celui qui mit en évidence la responsabilité du trabeculum et du mur interne du canal de Schlemm dans la résistance a l'évacuation de l'humeur aqueuse. Il fut aussi le pionnier dans la réalisation d'actions trabéculaires ab-interno pour lever ces obstacles à l'écoulement (sans aucun contrôle direct endoculaire) dans le traitement des glaucomes à angle ouvert. Ces techniques précédèrent la trabéculectomie de Cairns.
L'apport de l'endoscopie est essentiel pour une telle approche.
Les principes de base de telles approches sont les suivantes :
*en abord externe, on court-circuite les collecteurs du canal de Schlemm, vers les veines épisclérales (trabéculectomie externe). L'excision sclérale et l'abord conjonctivale sont nécessaires.
*en interne, on effondre le trabéculum dans son épaisseur totale et la paroi interne ( et +/- externe ) du canal de Schlemm (schlemmectomie) pour emprunter directement les canaux collecteurs. On respecte la conjonctive et la sclère.
But de la technique : " enlever la trabéculum dand toute son épaisseur ( ** ) et le mur interne du canal de schlemm, en préservant surtout le mur externe et les collecteurs d'aval intra-scleraux mais aussi en avant - la ligne de Schwalbe ( et la péripherie rétinienne ) et en arrière - l'éperon scléral (et la racine d'iris).
**Rappel : le trabeculum est constitué de la profondeur vers la superficie ,
* trabéculum uveal (de l'anneau de schwalbe à l'éperon scléral, corps ciliaire, et racine d'iris),
* trabéculum cornéoscléral (étendu de l'anneau de Schwalbe à l'éperon scléral), et
* trabéculum juxtacanaliculaire ou cribriforme (sous le précédent, contre le mur interne du canal de Schlemm)
Le canal de Schlemm est situé dans la gouttière sclérale, avec le septum scléral (en avant), le trabéculum (en arrière), et l'éperon scléral (à la périphérie).
Il a la structure histologique d'un vaisseau, ( endothelium, cellules endotheliales), de 200 a 370µ de diamètre interne.
La trabéculectomie interne ( protocole Leon )est une technique réalisée à 2 mains (trabéculotome, et endoscope) ; la canule d'aspiration détache le trabeculum( effet "rape" ) tout en aspirant ( niveau d'aspiration de 100 a 200 mm hg ) pendant 2 à 3 minutes sur180°, en méridien nasal horizontal (là où le nombre de collecteurs efferents du canal de schlemm y sont les plus nombreux) et à la partie postérieure du trabéculum ( là où le trabéculum cornéoscléral est le plus large et le plus épais).
Le contrôle gonioscopique pré- et post-opératoire complète celui per-opératoire -endoscopique-
A moyen terme, on ne doit retrouver aucune goniosynechies.
Résultats favorables : normotonie ( = néo-filtration drainage convenables par passage direct de l'humeur aqueuse dans les collecteurs du canal de Schlemm ).
Resultats défavorables :
*hypertonie,
1) par cicarisation obstruante (modification des cellules endothéliales du mur externe du canal de Schlemm ou des collecteurs de celui-ci), 2)par hémorragie mal résorbée, encombrement par des hématies modifiées (rigides et peu déformables après séjour en chambre anterieure)
*hypotonie, par cyclodialyse ou iridodialyse
On réalise l'excision des goniodysgénésies et membrane de Barkan sous contrôle permanent endoscopique. Le geste est d'une grande précision surtout en cas de cornée oedémateuse, empêchant une observation gonioscopique. L'endoscopie évite tout appui sur la cornée pendant l'intervention (sans verre à gonioscopie).
c) Rétine et endoscopie
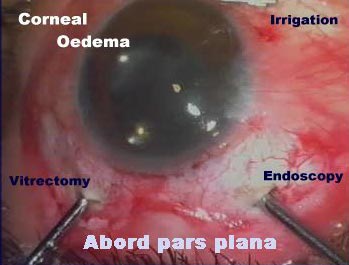
Le segment postérieur se prête bien à l'approche endoscopique pour plusieurs raisons :
1. les voies d'abord classiques à la pars plana sont parfaitement adaptées au passage d'un endoscope d'un diamètre total de 20 G (environs 0.9 mm). La sonde endoscopique peut emprunter chacune des 2 ou 3 sclérotomies : le plus souvent, l'endoscope est tenu "à main gauche" tandis que la main droite guide le vitréotome ou l'instrument vitréo-rétinien utilisé.
2. l'éclairage du microendoscope remplace la sonde d'endoillumination, en sachant que les sources et conducteurs de lumière utilisées sont les mèmes dans les deux cas (source Xénon, fibres optiques, puissances réglables de 150, 175, ou 300 watts)
3. l'espace disponible intra-vitréen est important, une fois le passage transscléral réalisé :
l'extrémité de l'endoscope peut être guidé à l'intérieur, plus ou moins près de la surface rétinienne. Plus proche de cette surface sera positionné l'endoscope, plus important sera le grossissement de l'image endoscopique et inversement pour le champ d'observation qui en sera d'autant plus réduit.
4. l'examen de la périphérie vitréo-rétinienne sera remarquable, la zone pré-équatoriale se situant exactement dans l'axe idéal d'observation endoscopique ( diamétralement opposée ). On évitera ainsi l'indentation parfois nécessaire pour un tel examen hors endoscopie.
5. plus qu'ailleurs, l'intérêt du contrôle de l'imagerie endoscopique "dans les binoculaires du microscope opératoire" sera ici important, compte tenu de la proximité de la surface rétinienne.
Les principales indications sont :
d) Traumatologie et endoscopie
En traumatologie "perforante", l'endoscope a précédé tous les autres instruments dans l'abord du segment postérieur, pour la recherche et l'extraction de corps étrangers intra-oculaires.
L'endoscopie fut la premiere indication d'abord intra-vitréen intra-oculaire il y a plus de 50 ans, bien avant le vitréotome !
On utilise l'endoscopie
* d'une part pour faire un bilan lésionnel précis antérieur et surtout postérieur,
* d'autre part pour aider à réparer (nettoyage intra-oculaire, recherche et extraction de CEIO, traitement de lésions rétiniennes associées,…)
L'endoscope pourra emprunter la même voie que celle de la lésion perforante (plaie sclérale) ou bénéficier de sa propre porte d'entrée (souvent diamétralement opposée à celle du traumatisme).
e) Voies lacrymales et endoscopie
L'endoscopie des voies lacrymales trouve un regain d'intéret ces dernières années grace aux progrès réalisés en rhinoendoscopie par les ORL : l'endoscopie nasale est devenue une spécialité à part entière tant médicale diagnostique que thérapeutique chirurgicale : presque toute la pathologie sinusienne est ainsi.couverte.
De plus, l'ophtalmologiste responsable de l'appareil lacrymal ne peut ni ne doit ignorer l'environnement sinusien du cadre orbitaire et ce que cache la cavité nasale : les cornets, les méats, la bosse lacrymale, les orifices sinusiens, le méat lacrymal inférieur…
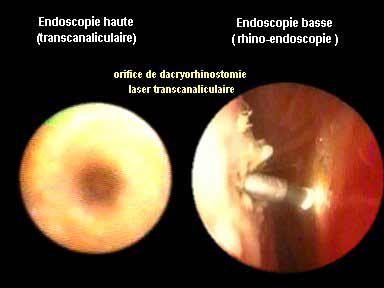
Les voies lacrymales font partie intégrante des deux cadres, orbitaire et nasal.
On doit dissocier au préalable deux types d'examen endoscopique :
*l'endoscopie lacrymale "basse", ou rhinoendoscopie, endoscopie nasale (endoscopie réalisée par abord nasal)
*l'endoscopie lacrymale "haute", ou endoscopie canaliculaire (réalisée par abord direct non invasif canaliculaire).
Anesthésie loco-régionale
Après nébulisation par Xylocaine 5%, méchage nasal par Xylocaine naphazolinée laissé en place au moins 1/4 d'heure. Infiltration du nerf nasal sous le ligament palpébral interne, contre le rebord orbitaire (par Xylocaine 2% non adrénalinée). De même, anesthésie canthale et palpébrale interne. Enfin, anesthésie cornéenne locale par Novésine 0.40%.
Endoscopie haute, nasale
On utilise un endoscope rigide de 4mm (chez l'adulte) ou de 2,7mm (chez l'enfant) idéalement à 45° d'axe d'observation.
Dès son introduction en cavité nasale, on met en évidence le cornet inférieur appendu à la face latérale de cette cavité : il recouvre le méat inférieur, au fond duquel siège l'orifice méatique inférieur de la voie lacrymale. Cet orifice méatique n'est pas toujours aisé à repérer : on s'y aidera par une injection de fluorescéine à partir du point lacrymal, ou cathéterisme par une sonde de Bowman par exemple.
En remontant dans la cavité nasale, on découvre les méat et cornet moyens : c'est cet espace méatique moyen qu'il est essentiel de bien connaître, car juste en avant de lui il faut savoir identifier la bosse lacrymale, zone élective de fistulisation lacrymo-nasale des dacryorhinostomies.
La transillumination lacrymo-nasale par une sonde d'illumination au contact osseux intra-sacculaire (en regard du canal d'union canaliculaire) permet de visualiser le lieu idéal de fistule par endoscopie nasale.
L'ophtalmologiste peut tout à fait se satisfaire uniquement de ces données ( méats et cornets inférieurs et moyens ) : elles lui seront suffisantes pour réaliser le plus grand nombre d'actes lacrymaux. Il ne doit pas négliger cependant toutes les autres possibilités que procure l'examen endoscopique nasal ,
La dacryorhinostomie par abord nasal ne pourra ètre faite que grâce au contrôle endoscopique endonasal permanent.
Endoscopie basse, Canaliculaire
Elle est réalisée par un fibroscope de 600 microns. Un lavage préalable des voies lacrymales est d'abord réalisé. Après dilatation du point lacrymal supérieur ( on peut aussi faire cet abord par le point lacrymal inférieur) et du canalicule, une canule de 1mm habitée d'une sonde de Bowman à extrémité mousse est introduite jusqu'au contact osseux, puis dans le canal lacrymo-nasal. La sonde est enlevée et remplacée par l'endoscope souple, glissé dans la canule, dont l'objectif affleure l'extrémité.
On remonte lentement l'ensemble réalisant ainsi une endoscopie lacrymale "rétrograde", observant de bas en haut le canal lacrymo-nasal, la jonction canal-sac lacrymal, le sac lacrymal et sa face médiale, le canal d'union canaliculaire et le canalicule.
Au cours de photodacryorhinostomie (par abord laser trans-canaliculaire), c'est la face médiale du sac lacrymal, dans sa partie exactement située en face du canal d'union canaliculaire, qui sera la zone cible de l'examen endoscopique intra-lacrymal. L'orifice d'ostéotomie laser sera apprécié in situ. Ce contrôle sera tout autant surveillé par rhinoendoscopie
L'appareil lacrymal appartient aux deux faces du mur laléral de la cavité nasale : les examens endoscopiques endonasal et endolacrymal méritent donc d'ètre le plus souvent complémentaires et associés, même si aujourd'hui encore l'endoscopie nasale est d'une séméiologie et d'une capacité d'imagerie plus riches que l'endoscopie trans canaliculaire encore vierge.
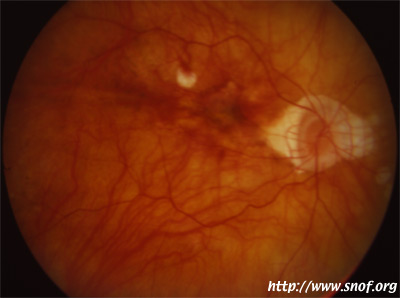
Myopie forte
Cliché Pr Mathis CHU Rangueil-Toulouse France
Le renforcement scléral est une technique chirurgicale qui consiste à essayer de diminuer l'évolution d'une myopie et la fréquence des complications, en sanglant le pôle postérieur de l'oeil avec une bande de PTFE ou polytétrafluoréthylène (téflon). Cette technique s'adresse aux myopies fortes (au delà de -10 dioptries), avec staphylome.
Cette technique est peu utilisée en France.
Traduction du résumé de l'article de D. Chauvaud, de Paris:
"Le renforcement scléral est proposé pour stabiliser l'acuité visuelle de patients présentant un staphylome myopique maculaire. Bien que de nombreux patients aient été traités, cette procédure est encore controversée.
BUT Evaluation de la réalisation du renforcement scléral et du risque opératoire.
PATIENTS ET METHODE Les patients ayant bénéficié de cette technique prospective étaient ceux ayant présenté une baisse de la vision, un staphylome maculaire associé à des lésions atrophiques ou des ruptures de la bruch. Seize yeux de treize patients ont été opérés, avec une seule bande de PTFE.
RESULTATS Lors du dernier examen l'acuité visuelle fut inchangée pour 14 yeux. Dans un cas, une amélioration de la vision fut mise en rapport avec la disparition d'un décollement maculaire par raccourcissement de la longueur axiale. Dans un cas la vision a diminué, ce qui fut corrélé à un mauvais positionnement de la bande. Une diplopie apparut dans deux cas. Un décollement choroidien, avec une hémorragie du vitré disparut avec des séquelles.
CONCLUSION Une technique précise est nécessaire pour éviter le risque opératoire. Des études sur le long terme sont nécessaires pour évaluer le bénéfice du renforcement scléral."
Chauvaud D, Assouline M, Perrenoud F. [Posterior scleral reinforcement surgery] Service d'Ophtalmologie, Hotel-Dieu, Paris. J Fr Ophtalmol 1997;20(5):374-82.
Scleral reinforcement is proposed to stabilize the visual acuity in patients with macular myopic staphyloma. Although many patients have been treated, this procedure is still debated. PURPOSE: Evaluation of the feasibility of scleral reinforcement and the operative risk of this procedure. PATIENTS AND METHODS: Patients were eligible for this prospective study patients with a clinical history of visual loss, staphyloma concerning the macular area associated with atrophic lesion and or lacquer cracks. Sixteen eyes in 13 successive patients have been operated on with a single band of PTFE. RESULTS: At the last examination, visual acuity was unchanged for 14 cases. In one case, an improvement of the vision was related to the disappearing of a macular detachment by shortening of the axial length. In one case, vision decline was associated with inadequate band position. Diplopia occurred in 2 cases. A choroidal detachment, and a vitreous haemorrhage disappeared without sequelae. CONCLUSION: An accurate technique is necessary to avoid operative risk. Further long term studies are needed to assess the benefit of scleral reinforcement.
Xu Y, Liu H, Niu T, et Al. [Long-term observation of curative effects of posterior scleral reinforcement surgery in patients with juvenile progressive myopia] Chung Hua Yen Ko Tsa Chih. 2000 Nov;36(6):455-8. Chinese.
Gerinec A, Slezakova G. [Posterior scleroplasty in children with severe myopia.] Bratisl Lek Listy. 2001;102(2):73-8.
Avetisov ES, Tarutta EP, Iomdina EN, Vinetskaya MI, Andreyeva LD. Nonsurgical and surgical methods of sclera reinforcement in progressive myopia. Acta Ophthalmol Scand. 1997 Dec;75(6):618-23.
Coroneo MT, Beaumont JT, Hollows FC. Scleral reinforcement in the treatment of pathologic myopia. Aust N Z J Ophthalmol. 1988 Nov;16(4):317-20.
Enculescu A. [Posterior scleral reinforcement in myopia--a harmless intervention?] Oftalmologia. 1991;35(3-4):85-6. Romanian.
Goldschmidt E. Myopia in humans: can progression be arrested? Ciba Found Symp. 1990;155:222-9; discussion 230-4. Review.
Jacob-LaBarre JT, Assouline M, Byrd T, McDonald M. Synthetic scleral reinforcement materials: I. Development and in vivo tissue biocompatibility response. J Biomed Mater Res. 1994 Jun;28(6):699-712.
Jacob-LaBarre JT, Assouline M, Conway MD, Thompson HW, McDonald MB. Effects of scleral reinforcement on the elongation of growing cat eyes. Arch Ophthalmol. 1993 Jul;111(7):979-86.
Karabatsas CH, Waldock A, Potts MJ. Cilioretinal artery occlusion following scleral reinforcement surgery. Acta Ophthalmol Scand. 1997 Jun;75(3):316-8.
Morelle N, Wery V, Croughs P. [Progressive myopia and posterior scleral reinforcement: retrospective studies] Bull Soc Belge Ophtalmol. 1996;262:43-5. French.
Riffenburgh RS. Dangers of scleral reinforcement for myopia. Ophthalmic Surg. 1985 Nov;16(11):730-1. No abstract available.
Thompson FB, Turner AF. Computed axial tomography on highly myopic eyes following scleral reinforcement surgery. Ophthalmic Surg. 1992 Apr;23(4):253-9.
Zhang J, Wu N. [Retinal detachment--severe complication after posterior scleral reinforcement operation] Chung Hua Yen Ko Tsa Chih. 1997 May;33(3):210-2. Chinese.
|
|
|
|
|
|
|
|
Nous remercions les Laboratoires Villanova pour leur coopération et leur iconographie,
ainsi que les patients qui ont donné leur accord.
Les progrès de la chirurgie ophtalmologique actuelle entraînent de moins en moins "d'oeil perdu".
Le nombre d'éviscération (on enlève l'intérieur de l'oeil et on ne garde que la sclére), d'énucléation (on enlève l'oeil) ou d'exentération (on enlève tout le contenu de l'orbite), diminue donc.
Malgré tout il arrive que des accidents de la vie quotidienne aboutissent à la perte fonctionnelle de l'oeil : celui ne fonctionne plus et a souvent un aspect peu esthétique. Le problème se pose aussi avec certaines maladies (herpès oculaire, uvéite grave, glaucome non traité...)
Ce sera alors le rôle de l'oculariste d'équiper le patient avec une prothèse à but esthétique; celle-ci permettra une vie sociale normale et le patient ne sentira plus le regard de l'entourage sur cet oeil blanc et dévié qui ne lui sert plus à rien.
Il existe en France 20 ocularistes répartis dans les différentes régions qui ont donc le rôle d'accueillir ces patients monophtalmes: ils vont prendre l'empreinte de la cavité orbitaire, des photos de l'oeil adelphe pour pouvoir reproduire la même couleur sur la prothèse.
On peut décrire trois type d'appareillage : le verre scléral, les prothèses mobiles sur implants "corail" et les épithèses :
 Verre scléral en place (traumatisme gauche) |
 Aspect avant la pose du verre scléral |
Parfois il est nécessaire d'équiper des enfants :
 Verre scléral en place (microphtalmie gauche) |
 Aspect avant la pose du verre scléral |
et quelques liens...
 Bonne mobilité de la prothèse droite |
 Aspect avant la pose de la prothèse corail |
 |
 |
Ces prothèses sont prises en charge par les Caisses d'Assurance Maladie :
TIPS :
Quelques liens :
ADEF (Epithèse.Prothèse faciale)
Worldoc: World Online Directory of Ocular Prosthetic Makers
American Society of Ocularists
National Examining Board of Ocularists Inc.(NEBO)
Nous vous proposerons d'autres éléments dans le premier trimestre 2000.

Préparation et conditionnement de la membrane amniotique délivrée par la banque de tissu de l'AP-HP..
Nous remercions beaucoup l'équipe de l'Hotel-Dieu (Pr Legeais, 1 Place du Parvis Notre-Dame. Paris. 75004 France) qui a fourni les documents pour réaliser ce chapitre.
La greffe de membrane amniotique (MAH) est un nouveau traitement chirurgical des maladies inflammatoires de la cornée.
Dans ces pathologies de surface cornéenne, il existe une destruction progressive de l'épithélium cornéen (surface de la cornée) avec son remplacement. par un épithélium anormal de type conjonctival associé à une vascularisation et une inflammation chronique faisant perdre sa transparence au tissu cornéen.
Dans ces conditions, une kératoplastie transfixiante ( greffe de cornée classique) est vouée à l'échec et ne doit pas être utilisée car les phénomènes inflammatoires actifs empêchent la cicatrisation.
La maladie est essentiellement à la surface de la cornée et respecte le reste de sa structure-, il n'y a donc aucune raison d'envisager un remplacement complet de la cornée par une cornée artificielle. C'est entre ces deux indications que se situe la greffe de MAH. La greffe de MAH permet d'apporter une structure avasculaire et acellulaire jouant le rôle de membrane basale ( support à l'épithélium) limitant le phénomène inflammatoire chronique, la vascularisation cornéenne et facilitant la cicatrisation épithéliale.

Coupe histologique d'une membrane amniotique après conservation pendant 3 mois à -80°c.
L'épithélium peut être enlevé avant utilisation par simple grattage de la membrane.
Cette greffe est aujourd'hui possible dans notre pays grâce à la constitution d'une filière assurant la collection, la préparation et la distribution de ces membranes. Cette greffe peut être aujourd'hui proposée comme traitement chirurgical des pathologies oculaires de surface. La réglementation qui s'applique aux greffes de membrane amniotique est celle de la greffe cornée. Une demande de remboursement de ces membranes a officiellement été déposée auprès de la sécurité sociale.
L'utilisation de membranes amniotiques est ancienne, puisqu'on les avait utilisées en chirurgie générale dès 1950; les premiers essais avaient été réalisés en 1910.
En ophtalmologie il fallut attendre 1940 pour que De Roth les utilise dans des altérations conjonctivales.
Les premières études cliniques ont été rapportées récemment aux USA, au Bascon-Palmer Eye Institute de Miami par le Professeur S.C.G. Tseng, puis au Japon. Elles furent utilisées isolément ou associées à des allogreffes limbiques.
Cette greffe est aujourd'hui possible en France grâce à la constitution d'une filière Française constituée au sein de l'AP-HP. La première greffe a été réalisée en France a l'Hôtel-Dieu de Paris le 10 novembre 1999. Les prélèvements sont actuellement réalisés à la maternité de Port Royal par l'équipe du Pr. D. Cabrol. Ils sont traités et conservés pendant quatre mois à la banque de tissu de l'Assistance Publique des hôpitaux de Paris (Hôp. Saint-Louis). Les greffes et le suivi post opératoire sont assurés actuellement à l'Hôtel-Dieu de Paris.
La greffe de MAH facilite la cicatrisation épithéliale avec une excellente tolérance clinique du fait de sa faible immunogénicité. Les membranes amniotiques (MAH) peuvent être associées à des autogreffes ou allogreffes de limbe dans le traitement des pathologies cornéennes de surface.
Les placentas sont recueillis après avoir obtenu un consentement éclairé de la patiente et exclusivement après délivrance par césarienne programmée d'un enfant normal et en bonne santé (directive 98/44/CE du 6/7/98, décret 97-928 du 9/10/97, décret 99-741 du 30/8/99).
Les placentas prélevés sont acheminés dans un conditionnement stérile vers la banque de tissu de Saint-Louis. Les membranes amniotiques sont préparées sous hotte à flux laminaire et conservées par cryocongélation pendant 3 mois. Cette quarantaine nécessaire permet un second contrôle de la séronégativité des femmes donneuses.
Le placenta est rincé en condition stérile à l'aide d'une solution saline contenant 50µg/mI de pénicilline, 50µg/mI de streptomycine, 100 µg/mI de néomycine et 2.5 µg/mI d'amphotéricine B. La membrane amniotique est alors détachée du chorion et apposée sur une membrane en nitrocellulose de telle sorte que la face épithéliale soit vers le haut.
La membrane est ensuite préparée en rectangle de 3 cm sur 4 cm. Elles sont ensuite conservées avant transplantation dans une solution stérile contenant 50% de DMEM ( Dulbecco's modified essential medium) et 50% de glycérol et placées à -80°c.
Tout au long de ces préparations on réalisera des contrôles bactériologiques et histologiques.
Avant utilisation, les membranes sont placées à température ambiante pendant environ 30 minutes. Elles sont retirées de leur milieu de conservation toujours posées sur filtre de nitrocellulose et greffées. On peut obtenir environ 30 greffons de 3 cm sur 4 cm à partir d'une seule membrane.
Toutes ces étapes permettent une traçabilité parfaite des membranes.
Les principales indications des greffes de MAH sont:
On estime à 500 par an le nombre de patients pouvant bénéficier de ce traitement, en France.

Décongélation de la membrane sur filtre de nitrocellulose avant son utilisation
La greffe de membrane amniotique peut être utilisée isolément et également comme chirurgie préparatoire à une greffe de cornée pour en améliorer le pronostic et diminuer les risques de rejet.
La chirurgie peut se faire sous anesthésie locale ou générale. Après avoir retiré le voile conjonctivo-vasculaire opacifiant la cornée, un patch de MAH est découpé avant d'être posé en regard des lésions et débordé légèrement la zone pathologique sur 360°. La suture se fait au Nylon 10.0.
En cas de destruction sévère du limbe, la greffe de membrane amniotique doit être associée systématiquement à une autogreffe ou à une allogreffe limbique nécessitant dans ce dernier cas l'utilisation de Ciclosporine en goutte ou per os.
Le traitement post opératoire est un traitement local associant le plus souvent un corticoïde ( acétate de prednisolone) et un antibiotique. Les posologies initiales sont élevées, 1 goutte toutes les heures avec une décroissance progressive sur un mois. Les fils sont retirés au bout de trois semaines environ.
Il reste un peu mystérieux et complexe, mais on sait que les MAH ont une action régulatrice de la cicatrisation épithéliale et de l'inflammation stromale.
L'épithélium sera détruit par la congélation, la lame basale est épaisse, la matrice stromale est avasculaire et on ne retrouve pas d'antigènes leucocytaires donc les rejets sont quasi inexistants.
La greffe de membrane amniotique est aujourd'hui possible en France et est diffusée depuis février 2000 dans les centres hospitaliers et les centres privés.
De Roth A. Plastic repair of conjunctival defects with fetal membranes. Arch Ophthalmol 1940; 23: 522-5.
Choi YS, Kim JY, Wee WR, Lee JH. Effect of the application of human amniotic membrane on rabbit corneal wound healing after excimer laser photorefractive keratectomy. Cornea 1998; 17:389-95.
Subrahmanyam M. Amniotic membrane as a cover for microskin grafts. Br j Plast Surg 1995; 48: 477-8.
Prabhasawat P, Tseng SC. Impression cytology study of epithetial phenotype of ocular surface reconstructed by preserved human amniotic membrane. Arch Ophthalmol. 1997; 115 : 1360-7.
Shimazaki J, Yang HY, Tsubota K. Amniotic membrane transplantation for ocular surface reconstruction in patients with chemical and thermal burns. Ophthalmology 1997; 104. 2068-76.
Shimazaki J, Shinozaki N, Tsubota K. Transplantation of amniotic membrane and limbal autograft for patients with recurrent pterygium associated with symblepharon. Br j Ophthalmol 1998; 82 : 235-40.
Tseng SC, Prabhasawat P, Barton K, Gray T, Meller D. Amniotic membrane transplantation with or without limbal allografts for corneal surface reconstruction in patients with limbal stem cell deficiency. Arch Ophthalmol 1998; 116:431-41.
Tseng SC, Prabhasawat P, Lee SH. Amniotic membrane transplantation for conjunctival surface reconstruction. Am J Ophthalmol 1997; 124 : 765-74.
Lee SH, Tseng SC. Amniotic membrane transplantation for persistent epithelial defects with ulceration. Am j Ophthalmol 1997. 123 :303-12.
Legeais JM. Greffe de membrane amniotique sur la cornée : une première en France. Les cahiers d'ophtalmologie. Janvier 2000 :7-9.
Honavar SG, Bansal AK, Sangwan VS, Rao GN. Amniotic membrane transplantation for ocular surface reconstruction in Stevens-Johnson syndrome. Ophthalmology. 2000 May;107(5):975-9.
Messmer EM, Hintschich CR, Partscht K, Messer G, Kampik A. Ocular cicatricial pemphigoid. Retrospective analysis of risk factors and complications. Ophthalmologe. 2000 Feb;97(2):113-20. Allemand.
Tan D. Conjunctival grafting for ocular surface disease. Curr Opin Ophthalmol. 1999 Aug;10(4):277-81..

Nous remercions les Dr Claude et Joseph Léon qui ont fourni l'ensemble des éléments permettant de présenter cette technique d'exploration et d'intervention chirurgicale.
Ce travail a pour but d'initier aux bases d'endoscopie tous les ophtalmologiste intéressés par cette approche originale diagnostique et thérapeutique. L'ophtalmologie sera obligatoirement endoscopique : l'endoscopie va peu à peu s'installer dans tous les les blocs opératoires d'ophtalmologie, se couplant harmonieusement au microscope opératoire, complémentairement indispensable.
|
|
<= Vallées et procès (Pars plicata)
<= Plis et stries (Pars plana)
<= Baies et dents (Ora serrata) |
L'endoscopie en ophtalmologie est une discipline naissante. Les ophtalmologistes la connaissent encore peu pour de multiples raisons.
En premier lieu parce que l'usage du microscope opératoire -à lui seul - donne déjà à l'opérateur l'impression d'avoir atteint les limites de la perfection en matière de contrôle interventionnel : en effet, il s'est doté des dernières technologies optiques permettant d'avoir une qualité d'image inégalable, de multiples motorisations le rendant plus convivial, d'adaptateurs vidéoélectroniques, d'inverseurs d'images, de filtres lasers, de commandes vocales, et de nombreux autres additifs.
Dès la fin de l'été 1984, au retour du congrès d'Harrogate de la sociéte européenne d'implantation, nous nous sommes intéressés à l'espace rétro-irien. Qui pouvait s'intéresser à une telle "zone d'ombre": puisque le microscope opératoire ne pouvait l'atteindre, cela devait signifier qu'elle n'avait pas d'importance.
Des milliers d'anses d'implants postérieurs croisaient le bord pupillaire pour rejoindre "au hasard de leur glissement" une partie invisible de l'espace rétro-irien. Il y avait un angle mort, une zone aveugle que l'impossibilité d'observer -à l'époque- semblait rendre futile et sans intérêt.
Quand nous y pénétrâmes la première fois, nous en fûmes tellement éblouis que l'image du microscope opératoire nous parut fade en comparaison, peut-être parce que toute l'imagerie que nous offrait l'observation endoscopique était nouvelle (les procès ciliaires, la zonule et l'équateur cristallinien, la pars plana, la base du vitré et la rétine ), mais surtout parce que nous pressentions que la virginité du sujet était telle qu'elle laissait présager une aussi bouleversante révolution pour l'ophtalmologie que celle du microscope opératoire vingt ans plus tôt.
Deux évidences s'imposèrent à nous d'emblée.
D'une part, l'endoscopie devait être étroitement unie au microscope opératoire pour former avec lui un ensemble indissociable et complémentaire : au microscope l'examen frontal, à l'endoscope l'observation sagittale.
D'autre part, toute la technologie d'approche intra-oculaire devait être soigneusement adaptée à l'ophtalmologie et ne pouvait se concevoir comme une pâle copie empruntée aux autres spécialités endoscopiques (comme l'orl, l'orthopédie, la gastro-entérologie, ou la neuro-chirurgie).
L'ophtalmologie endoscopique nécessitait le développement de la microendoscopie (endoscopes voisins de 1 mm, léon-efer-storz) et de son couplage au microscope opératoire ( appelé "système endomicroscope", ou comment observer les images endoscopiques à travers le binoculaire du microscope opératoire, (léon-institut d'optique de Paris). Enfin, travaux sur la lumière d'éclairage (jacques vulmiere-léon école supérieure d'optique Paris ) et sur le couplage aux lasers (léon-société française de lasers médicaux ).
La microchirurgie endoscopique, ou endoscopie microchirurgicale était née : il ne lui restait plus qu'à grandir, avec l'opiniâtreté de tous et l'opportunité des progrès technologiques.
Les ainés pionniers nous ont toujours entourés de leur confiance et encouragements, parfois fait de rencontres informelles, souvent d'une proximité relationnelle : d. Aron-rosa, c.d. Kelman, k. Miyake, a.Galand, r. Lindstrom, m.Blumenthal, l.Buratto, g. Coscas, j.Haut, ph. Sourdille, f.Fankhauser, a. Ditmar, p.De Laage, etc.
Le courant endoscopique international en ophtalmologie s'installe progressivement : m.Uram, s.Eguchi, d. Bremond-gignac, k. Joos, y. Fisher, c.Boscher, j.Alvarado, j.Gayton, p.Rol, n.b. Medow, etc.
Préambule
La majorité des matériels cités ne sont pas encore commercialisés, en phase de projet avancé pour grand nombre d'entre eux. Si à l'heure actuelle, il est difficile pour un opérateur de trouver l'éventail de produits nécessaires, il aura bientôt l'embarras du choix. Autour des années 1980, il n'était pas aisé de trouver un phacoémulsificateur. Aujourd'hui…
Nous conseillons donc vivement aux intéressés de ne rien précipiter dans leurs choix présents.
Le matériel endoscopique se compose de trois composants :
=> l'endoscope
=> l'endomicroscope ( élément de couplage endoscope-microscope)
=> le matériel annexe
Il est rigide : bien que ce terme soit le plus souvent réservé aux endoscopes constitués de micro-lentilles additionnelles, cela est différent en microendoscopie car la sonde est habitée simplement par une tige de verre conductrice de l'image (ou "selfoc"), entourée de fibres optiques d'éclairage (coaxial).

L'oculaire (oeilleton) est réporté à 1mètre de la pièce à main elle-même, afin de libérer l'espace de travail, et permettre sa connectique au microscope opératoire.

Certains le connectent directement à l'objectif d'une caméra, réalisant ainsi une vidéoendoscopie. Cette méthode n'est pas adaptée à la pratique endoscopique en microchirurgie (dangereux perte de controle du champ opératoire lorsque l'opérateur regarde l'écran vidéo "endoscope en position intra-oculaire").
Par contre il est vivement recommandé d'utiliser un ensemble optronique ( endoscope constitué d'un objectif optique et d'un corps d'oculaire électronique de type CCD intégré) pour recueillir une image de meilleure qualité tout en requérant beaucoup moins de lumière d'éclairage : cet endoscope optronique sera connecté directement à l'endomicroscope pour permettre de travailler sur une image électronique directement à travers le binoculaire du microscope opératoire.
Tous les microendoscopes sont d'ailleurs réalisés sur le même principe de base : wolf, olympus, storz, …et sont tous adaptables à l'endomicroscope.
Les microendoscopes peuvent être purement optiques (image optique, transmission optique), ou optronique (image optique transmise de maniere électronique). Peut-être pourront-ils être bientôt "tout électronique" ( nécessitant alors un capteur ccd comme objectif, prouesse technologique pour 1 mm de diamètre ).
L'important n'est pas tant le moyen physique utilisé que le résultat, la qualité de l'image endoscopique. Le microchirurgien est trop habitué a l'excellence de l'imagerie du microscope opératoire pour se contenter d'images endoscopiques médiocres.
L'endomicroscope s'intercale entre les oculaires et l'objectif du microscope.

Tous les microscopes sont connectables, méritant chacun une pièce spécifique de couplage (moller-wedel, zeiss, wild, topcon, …)
L'opérateur se trouve ainsi confiné "dans un ensemble de champs d'observation sous contrôle permanent dans les binoculaires du microscope opératoire", champs choisis à sa convenance en fonction des nécessités interventionnelles, soit frontal (axial) pour le champ microscope, soit sagittal (latéral) pour le champ endoscopique.
Les générateurs de lumiere froide au xénon 300 watts sont conseillés, avec variateur de puissance à la demande.
Les conducteurs les mieux adaptés sont des cables dont le contenant est un liquide, permettant d'augmenter de 30% environs la transmission de lumière.

L'abord endoscopique peut se faire soit en segment antérieur, soit postérieur.
Le plus souvent, l'endoscope emprunte les voies d'abord d'instruments antérieurs (sonde phaco, micromanipulateur, canule d'irrigation, …), ou postérieurs (vitréotome, sonde d'endoillumination, …).
Cependant, un certain nombre d'indications imposent à l'endoscope une voie d'abord sélective (glaucomes réfractaires, CEIO, …)
En segment postérieur, l'endoscopie rend le plus souvent obsolète l'utilisation de la sonde d'endoillumination remplacée judicieusement par le seul éclairage de l'endoscope : il est inutile de multiplier les sources d'éclairage intra-oculaires simultanément.
Plus l'abord endoscopique sera antérieur, plus l'obliquite de l'axe interventionnel d'observation de l'endoscope sera important.
Trois abords principaux peuvent être définis :

L'endoscope est toujours introduit éteint afin de minimiser les temps d'exposition de la lumiere d'éclairage. Il est souvent précédé en segment antérieur d'injection de substance visco-élastique pour avoir un espace d'examen bien dilaté, respectant mieux les contraintes de distance focale qu'exige la microendoscopie.
L'introduction intra-oculaire de l'endoscope, ses déplacements et sa situation exacte à tous moments de l'intervention sont contrôlés par le microscope opératoire. La commutation "endoscopique", avec mise en fonction de la lumière d'éclairage de l'endoscope (système"endomicroscope", cf matériel) permet l'observation du champ d'examen endoscopique "toujours sous binoculaire du microscope opératoire"). L'opérateur passera ainsi en permanence de la vision des champs d'observation du microscope opératoire (axial), à ceux de l'endoscope (sagittal). L'apprentissage du "réflexe de défocalisation", l'arrêt automatique d'éclairage endoscopique en commutation "microscope", et le liquide d'irrigation-refroidissement de sonde en cours d'examen endoscopique permettent d'éviter les risques de phototraumatismes par la lumière d'éclairage endoscopique.
L'examen endoscopique permet de définir une entité antomo-endoscopique sagittale appelée l'angle cornéo-ciliaire, divisé horizontalement par le rideau irien en 2 parties antérieur ou pré-irien et postérieur ou rétro-irien.
Notons que la racine de l'iris s'insère sur le muscle ciliaire le séparant en deux élements, antérieur ou bande ciliaire, et postérieur ou sulcus ciliaire.

L'angle cornéo-ciliaire présente d'avant en arrière :

a) Cataracte et endoscopie
Cinq indications principales, non exhaustives, méritant chacune un développement tout particulier :
1.Contrôle de position des anses d'implants postérieurs
 Implant postérieur dans le sulcus ciliaire |
 Implant postérieur luxé en avant de la couronne cilaire |
2.Examen de la péripherie de la chambre postérieure : reliquats corticaux, éléments vitréens, sang,. …
Cet examen sera d'autant plus justifié qu'il existe une fermeture pupillaire.
C'est aussi la meilleure qualité du nettoyage vitréen antérieur qui réduira les complications rétiennes secondaires.
3.Observation précise du site de suture au sulcus en cas d'implantation postérieure suturée, soit au cours de phaco compliquée d'accident vitréen, soit au cours d'implantation secondaire avec ou sans kératoplastie perforante.
4.Analyse de la situation de l'anneau de tension du sac : cela permettra d'avoir la certitude objective qu'une partie de cet anneau ne se soit introduit dans une brèche capsulo-zonulaire, et ne compromette la suite de l'intervention.
5. Implantation postérieure suturée : si l'indication de suture d'implant postérieur est posée, elle doit se faire "ab-interno et sous contrôle endoscopique permanent". Le contrôle parfait du site de perforation interne de l'aiguille, idéalement au sulcus, ne peut se faire que grâce à l'endoscopie. Toutes les autres méthodes, ab-externo ou ab-interno sans contrôle sont totalement "aveugles" et exposent aux complications graves des fausses routes antérieures " iriennes ) ou postérieures ( base du vitré, rétine )

b) Glaucome et endoscopie
Un certain nombre de méthodes chirurgicales sont utilisables pour intervenir sur les deux sites, de sécrétion ou d'évacuation : méthodes ab-externo actuellement les plus courantes, et méthodes ab-interno, plus récentes car étroitement dépendantes des moyens d'observation per-opératoires (endoscopiques).
L'endoscopie par ses capacités d'abord sagittal permet le contrôle parfait pré ou rétro-irien de tous les sites fonctionnels d'action " tensionnel ". Aux indications ab-externo, non invasives pour la plupart, mais très souvent " aveugles " (cyclodestuction transclérale) s'ajoutent les indications ab-interno, invasives (le plus souvent minimalement), mais autorisant un contrôle endoculaire parfait du site d'action :
*angle irido-cornéen, centré sur le trabeculum
*et l'angle irido-ciliaire, centré sur la couronne ciliaire.
Plusieurs méthodes peuvent être appliquées. Certaines telle la cyclophotocoagulation ou la goniotomie sont largement validées, d'autres encore embryonnaire méritent un recul suffisant pour l'être :

L'endoscope contrôle l'action qualitative et quantitative de l'action laser sur les procès : ni surdosage ou sous-dosage (puissance du laser parfaitement adaptée), pas de fausses routes ( précision des impacts sur la tête ou les versants des procès).
La fibre laser est coaxiale à l'endoscope. La longueur d'onde peut être celle d'un ktp (532 nm), soit celle d'un semi-conducteur (810 nm). La préférence ira au second car le filtre n'aura pas de caractéristique spectrale dans le "visible" beaucoup plus contraignant pour le rendu de l'image endoscopique ( ex. laser KTP)
C'est l'épithelium pigmenté du procès qui absorbe la plus grande partie du rayonnement (site d'action électif). La diffusion thermique se fait ensuite par contiguité vers les couches de l'épithélium non-pigmenté, vers les membranes basales internes et externes, et vers les capillaires ciliaires du stroma ciliaire. Ainsi, le procès est détruit, réduisant considérablement sa valeur fonctionnelle sécrétante.
L'action efficace se manifeste par un intense blanchiment, et une contraction tissulaire, sans dispersion pigmentaire ni bulles de vaporisation (signes de surdosage).
90 a 110° de couronne ciliaire est ainsi traitée.
Idéal sur oeil aphake...juste après phaco et avant implantation.
Comparer avantages et inconvénients des méthodes ab-interno contrôlées et ab-externo "aveugles" telles les cyclophotocoagulations transclérales.

Morton W. Grant (1954-1957) fut celui qui mit en évidence la responsabilité du trabeculum et du mur interne du canal de Schlemm dans la résistance a l'évacuation de l'humeur aqueuse. Il fut aussi le pionnier dans la réalisation d'actions trabéculaires ab-interno pour lever ces obstacles à l'écoulement (sans aucun contrôle direct endoculaire) dans le traitement des glaucomes à angle ouvert. Ces techniques précédèrent la trabéculectomie de Cairns.
L'apport de l'endoscopie est essentiel pour une telle approche.
Les principes de base de telles approches sont les suivantes :
*en abord externe, on court-circuite les collecteurs du canal de Schlemm, vers les veines épisclérales (trabéculectomie externe). L'excision sclérale et l'abord conjonctivale sont nécessaires.
*en interne, on effondre le trabéculum dans son épaisseur totale et la paroi interne ( et +/- externe ) du canal de Schlemm (schlemmectomie) pour emprunter directement les canaux collecteurs. On respecte la conjonctive et la sclère.
But de la technique : " enlever la trabéculum dand toute son épaisseur ( ** ) et le mur interne du canal de schlemm, en préservant surtout le mur externe et les collecteurs d'aval intra-scleraux mais aussi en avant - la ligne de Schwalbe ( et la péripherie rétinienne ) et en arrière - l'éperon scléral (et la racine d'iris).
**Rappel : le trabeculum est constitué de la profondeur vers la superficie ,
* trabéculum uveal (de l'anneau de schwalbe à l'éperon scléral, corps ciliaire, et racine d'iris),
* trabéculum cornéoscléral (étendu de l'anneau de Schwalbe à l'éperon scléral), et
* trabéculum juxtacanaliculaire ou cribriforme (sous le précédent, contre le mur interne du canal de Schlemm)
Le canal de Schlemm est situé dans la gouttière sclérale, avec le septum scléral (en avant), le trabéculum (en arrière), et l'éperon scléral (à la périphérie).
Il a la structure histologique d'un vaisseau, ( endothelium, cellules endotheliales), de 200 a 370µ de diamètre interne.
La trabéculectomie interne ( protocole Leon )est une technique réalisée à 2 mains (trabéculotome, et endoscope) ; la canule d'aspiration détache le trabeculum( effet "rape" ) tout en aspirant ( niveau d'aspiration de 100 a 200 mm hg ) pendant 2 à 3 minutes sur180°, en méridien nasal horizontal (là où le nombre de collecteurs efferents du canal de schlemm y sont les plus nombreux) et à la partie postérieure du trabéculum ( là où le trabéculum cornéoscléral est le plus large et le plus épais).
Le contrôle gonioscopique pré- et post-opératoire complète celui per-opératoire -endoscopique-
A moyen terme, on ne doit retrouver aucune goniosynechies.
Résultats favorables : normotonie ( = néo-filtration drainage convenables par passage direct de l'humeur aqueuse dans les collecteurs du canal de Schlemm ).
Resultats défavorables :
*hypertonie,
1) par cicarisation obstruante (modification des cellules endothéliales du mur externe du canal de Schlemm ou des collecteurs de celui-ci), 2)par hémorragie mal résorbée, encombrement par des hématies modifiées (rigides et peu déformables après séjour en chambre anterieure)
*hypotonie, par cyclodialyse ou iridodialyse
On réalise l'excision des goniodysgénésies et membrane de Barkan sous contrôle permanent endoscopique. Le geste est d'une grande précision surtout en cas de cornée oedémateuse, empêchant une observation gonioscopique. L'endoscopie évite tout appui sur la cornée pendant l'intervention (sans verre à gonioscopie).
c) Rétine et endoscopie

Le segment postérieur se prête bien à l'approche endoscopique pour plusieurs raisons :
1. les voies d'abord classiques à la pars plana sont parfaitement adaptées au passage d'un endoscope d'un diamètre total de 20 G (environs 0.9 mm). La sonde endoscopique peut emprunter chacune des 2 ou 3 sclérotomies : le plus souvent, l'endoscope est tenu "à main gauche" tandis que la main droite guide le vitréotome ou l'instrument vitréo-rétinien utilisé.
2. l'éclairage du microendoscope remplace la sonde d'endoillumination, en sachant que les sources et conducteurs de lumière utilisées sont les mèmes dans les deux cas (source Xénon, fibres optiques, puissances réglables de 150, 175, ou 300 watts)
3. l'espace disponible intra-vitréen est important, une fois le passage transscléral réalisé :
l'extrémité de l'endoscope peut être guidé à l'intérieur, plus ou moins près de la surface rétinienne. Plus proche de cette surface sera positionné l'endoscope, plus important sera le grossissement de l'image endoscopique et inversement pour le champ d'observation qui en sera d'autant plus réduit.
4. l'examen de la périphérie vitréo-rétinienne sera remarquable, la zone pré-équatoriale se situant exactement dans l'axe idéal d'observation endoscopique ( diamétralement opposée ). On évitera ainsi l'indentation parfois nécessaire pour un tel examen hors endoscopie.
5. plus qu'ailleurs, l'intérêt du contrôle de l'imagerie endoscopique "dans les binoculaires du microscope opératoire" sera ici important, compte tenu de la proximité de la surface rétinienne.
Les principales indications sont :
d) Traumatologie et endoscopie
En traumatologie "perforante", l'endoscope a précédé tous les autres instruments dans l'abord du segment postérieur, pour la recherche et l'extraction de corps étrangers intra-oculaires.
L'endoscopie fut la premiere indication d'abord intra-vitréen intra-oculaire il y a plus de 50 ans, bien avant le vitréotome !
On utilise l'endoscopie
* d'une part pour faire un bilan lésionnel précis antérieur et surtout postérieur,
* d'autre part pour aider à réparer (nettoyage intra-oculaire, recherche et extraction de CEIO, traitement de lésions rétiniennes associées,…)
L'endoscope pourra emprunter la même voie que celle de la lésion perforante (plaie sclérale) ou bénéficier de sa propre porte d'entrée (souvent diamétralement opposée à celle du traumatisme).
e) Voies lacrymales et endoscopie
L'endoscopie des voies lacrymales trouve un regain d'intéret ces dernières années grace aux progrès réalisés en rhinoendoscopie par les ORL : l'endoscopie nasale est devenue une spécialité à part entière tant médicale diagnostique que thérapeutique chirurgicale : presque toute la pathologie sinusienne est ainsi.couverte.
De plus, l'ophtalmologiste responsable de l'appareil lacrymal ne peut ni ne doit ignorer l'environnement sinusien du cadre orbitaire et ce que cache la cavité nasale : les cornets, les méats, la bosse lacrymale, les orifices sinusiens, le méat lacrymal inférieur…

Les voies lacrymales font partie intégrante des deux cadres, orbitaire et nasal.
On doit dissocier au préalable deux types d'examen endoscopique :
*l'endoscopie lacrymale "basse", ou rhinoendoscopie, endoscopie nasale (endoscopie réalisée par abord nasal)
*l'endoscopie lacrymale "haute", ou endoscopie canaliculaire (réalisée par abord direct non invasif canaliculaire).
Anesthésie loco-régionale
Après nébulisation par Xylocaine 5%, méchage nasal par Xylocaine naphazolinée laissé en place au moins 1/4 d'heure. Infiltration du nerf nasal sous le ligament palpébral interne, contre le rebord orbitaire (par Xylocaine 2% non adrénalinée). De même, anesthésie canthale et palpébrale interne. Enfin, anesthésie cornéenne locale par Novésine 0.40%.
Endoscopie haute, nasale
On utilise un endoscope rigide de 4mm (chez l'adulte) ou de 2,7mm (chez l'enfant) idéalement à 45° d'axe d'observation.
Dès son introduction en cavité nasale, on met en évidence le cornet inférieur appendu à la face latérale de cette cavité : il recouvre le méat inférieur, au fond duquel siège l'orifice méatique inférieur de la voie lacrymale. Cet orifice méatique n'est pas toujours aisé à repérer : on s'y aidera par une injection de fluorescéine à partir du point lacrymal, ou cathéterisme par une sonde de Bowman par exemple.
En remontant dans la cavité nasale, on découvre les méat et cornet moyens : c'est cet espace méatique moyen qu'il est essentiel de bien connaître, car juste en avant de lui il faut savoir identifier la bosse lacrymale, zone élective de fistulisation lacrymo-nasale des dacryorhinostomies.
La transillumination lacrymo-nasale par une sonde d'illumination au contact osseux intra-sacculaire (en regard du canal d'union canaliculaire) permet de visualiser le lieu idéal de fistule par endoscopie nasale.
L'ophtalmologiste peut tout à fait se satisfaire uniquement de ces données ( méats et cornets inférieurs et moyens ) : elles lui seront suffisantes pour réaliser le plus grand nombre d'actes lacrymaux. Il ne doit pas négliger cependant toutes les autres possibilités que procure l'examen endoscopique nasal ,
La dacryorhinostomie par abord nasal ne pourra ètre faite que grâce au contrôle endoscopique endonasal permanent.
Endoscopie basse, Canaliculaire
Elle est réalisée par un fibroscope de 600 microns. Un lavage préalable des voies lacrymales est d'abord réalisé. Après dilatation du point lacrymal supérieur ( on peut aussi faire cet abord par le point lacrymal inférieur) et du canalicule, une canule de 1mm habitée d'une sonde de Bowman à extrémité mousse est introduite jusqu'au contact osseux, puis dans le canal lacrymo-nasal. La sonde est enlevée et remplacée par l'endoscope souple, glissé dans la canule, dont l'objectif affleure l'extrémité.
On remonte lentement l'ensemble réalisant ainsi une endoscopie lacrymale "rétrograde", observant de bas en haut le canal lacrymo-nasal, la jonction canal-sac lacrymal, le sac lacrymal et sa face médiale, le canal d'union canaliculaire et le canalicule.
Au cours de photodacryorhinostomie (par abord laser trans-canaliculaire), c'est la face médiale du sac lacrymal, dans sa partie exactement située en face du canal d'union canaliculaire, qui sera la zone cible de l'examen endoscopique intra-lacrymal. L'orifice d'ostéotomie laser sera apprécié in situ. Ce contrôle sera tout autant surveillé par rhinoendoscopie
L'appareil lacrymal appartient aux deux faces du mur laléral de la cavité nasale : les examens endoscopiques endonasal et endolacrymal méritent donc d'ètre le plus souvent complémentaires et associés, même si aujourd'hui encore l'endoscopie nasale est d'une séméiologie et d'une capacité d'imagerie plus riches que l'endoscopie trans canaliculaire encore vierge.

Myopie forte
Cliché Pr Mathis CHU Rangueil-Toulouse France
Le renforcement scléral est une technique chirurgicale qui consiste à essayer de diminuer l'évolution d'une myopie et la fréquence des complications, en sanglant le pôle postérieur de l'oeil avec une bande de PTFE ou polytétrafluoréthylène (téflon). Cette technique s'adresse aux myopies fortes (au delà de -10 dioptries), avec staphylome.
Cette technique est peu utilisée en France.
Traduction du résumé de l'article de D. Chauvaud, de Paris:
"Le renforcement scléral est proposé pour stabiliser l'acuité visuelle de patients présentant un staphylome myopique maculaire. Bien que de nombreux patients aient été traités, cette procédure est encore controversée.
BUT Evaluation de la réalisation du renforcement scléral et du risque opératoire.
PATIENTS ET METHODE Les patients ayant bénéficié de cette technique prospective étaient ceux ayant présenté une baisse de la vision, un staphylome maculaire associé à des lésions atrophiques ou des ruptures de la bruch. Seize yeux de treize patients ont été opérés, avec une seule bande de PTFE.
RESULTATS Lors du dernier examen l'acuité visuelle fut inchangée pour 14 yeux. Dans un cas, une amélioration de la vision fut mise en rapport avec la disparition d'un décollement maculaire par raccourcissement de la longueur axiale. Dans un cas la vision a diminué, ce qui fut corrélé à un mauvais positionnement de la bande. Une diplopie apparut dans deux cas. Un décollement choroidien, avec une hémorragie du vitré disparut avec des séquelles.
CONCLUSION Une technique précise est nécessaire pour éviter le risque opératoire. Des études sur le long terme sont nécessaires pour évaluer le bénéfice du renforcement scléral."
Chauvaud D, Assouline M, Perrenoud F. [Posterior scleral reinforcement surgery] Service d'Ophtalmologie, Hotel-Dieu, Paris. J Fr Ophtalmol 1997;20(5):374-82.
Scleral reinforcement is proposed to stabilize the visual acuity in patients with macular myopic staphyloma. Although many patients have been treated, this procedure is still debated. PURPOSE: Evaluation of the feasibility of scleral reinforcement and the operative risk of this procedure. PATIENTS AND METHODS: Patients were eligible for this prospective study patients with a clinical history of visual loss, staphyloma concerning the macular area associated with atrophic lesion and or lacquer cracks. Sixteen eyes in 13 successive patients have been operated on with a single band of PTFE. RESULTS: At the last examination, visual acuity was unchanged for 14 cases. In one case, an improvement of the vision was related to the disappearing of a macular detachment by shortening of the axial length. In one case, vision decline was associated with inadequate band position. Diplopia occurred in 2 cases. A choroidal detachment, and a vitreous haemorrhage disappeared without sequelae. CONCLUSION: An accurate technique is necessary to avoid operative risk. Further long term studies are needed to assess the benefit of scleral reinforcement.
Xu Y, Liu H, Niu T, et Al. [Long-term observation of curative effects of posterior scleral reinforcement surgery in patients with juvenile progressive myopia] Chung Hua Yen Ko Tsa Chih. 2000 Nov;36(6):455-8. Chinese.
Gerinec A, Slezakova G. [Posterior scleroplasty in children with severe myopia.] Bratisl Lek Listy. 2001;102(2):73-8.
Avetisov ES, Tarutta EP, Iomdina EN, Vinetskaya MI, Andreyeva LD. Nonsurgical and surgical methods of sclera reinforcement in progressive myopia. Acta Ophthalmol Scand. 1997 Dec;75(6):618-23.
Coroneo MT, Beaumont JT, Hollows FC. Scleral reinforcement in the treatment of pathologic myopia. Aust N Z J Ophthalmol. 1988 Nov;16(4):317-20.
Enculescu A. [Posterior scleral reinforcement in myopia--a harmless intervention?] Oftalmologia. 1991;35(3-4):85-6. Romanian.
Goldschmidt E. Myopia in humans: can progression be arrested? Ciba Found Symp. 1990;155:222-9; discussion 230-4. Review.
Jacob-LaBarre JT, Assouline M, Byrd T, McDonald M. Synthetic scleral reinforcement materials: I. Development and in vivo tissue biocompatibility response. J Biomed Mater Res. 1994 Jun;28(6):699-712.
Jacob-LaBarre JT, Assouline M, Conway MD, Thompson HW, McDonald MB. Effects of scleral reinforcement on the elongation of growing cat eyes. Arch Ophthalmol. 1993 Jul;111(7):979-86.
Karabatsas CH, Waldock A, Potts MJ. Cilioretinal artery occlusion following scleral reinforcement surgery. Acta Ophthalmol Scand. 1997 Jun;75(3):316-8.
Morelle N, Wery V, Croughs P. [Progressive myopia and posterior scleral reinforcement: retrospective studies] Bull Soc Belge Ophtalmol. 1996;262:43-5. French.
Riffenburgh RS. Dangers of scleral reinforcement for myopia. Ophthalmic Surg. 1985 Nov;16(11):730-1. No abstract available.
Thompson FB, Turner AF. Computed axial tomography on highly myopic eyes following scleral reinforcement surgery. Ophthalmic Surg. 1992 Apr;23(4):253-9.
Zhang J, Wu N. [Retinal detachment--severe complication after posterior scleral reinforcement operation] Chung Hua Yen Ko Tsa Chih. 1997 May;33(3):210-2. Chinese.
